题目内容
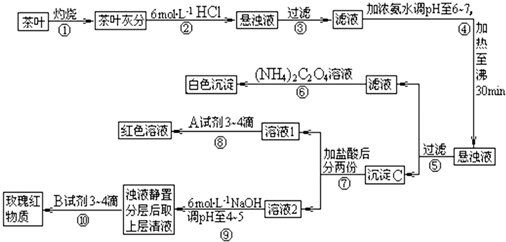
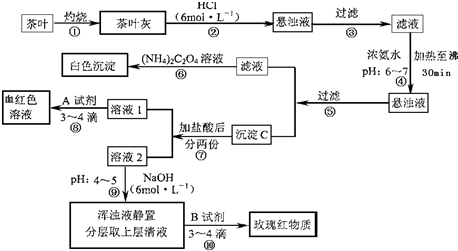
茶是我国人民喜爱的饮品.某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、Al、Fe三种元素.
【资料查询】:草酸铵[(NH4)2C2O4]属于弱电解质.草酸钙(CaC2O4)难溶于水.Ca2+、Al3+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1.
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 .
(2)步骤③操作中用到的玻璃仪器有 .
(3)写出步骤⑥中检验Ca2+存在的离子方程式 .
(4)写出沉淀C所含主要物质的化学式 .
(5)写出步骤⑧中选用A试剂的化学式 .
(6)步骤⑨的作用是 ,猜测步骤⑩的目的是 .

【资料查询】:草酸铵[(NH4)2C2O4]属于弱电解质.草酸钙(CaC2O4)难溶于水.Ca2+、Al3+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1.
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是
(2)步骤③操作中用到的玻璃仪器有
(3)写出步骤⑥中检验Ca2+存在的离子方程式
(4)写出沉淀C所含主要物质的化学式
(5)写出步骤⑧中选用A试剂的化学式
(6)步骤⑨的作用是
分析:茶叶经灼烧,茶叶灰中含有钙、铁、铝三种金属元素,加入盐酸后可生成可溶性的氯化物,经过滤后,在滤液中加入氨水调节pH6~7,加热至沸30min,经过滤得到的沉淀C为氢氧化铝和氢氧化铁沉淀,滤液为氯化钙溶液,加入草酸铵后可得草酸钙沉淀,在滤液中加入盐酸后分为两份,加入试剂A,溶液变成红色,则A应为KSCN溶液,溶液2中加入6mol/L的NaOH溶液调pH至4,可得到氢氧化铁沉淀,浊液静置分层后上层清液为氯化铝溶液,加入试剂B可检验铝离子,生成红色络合物,以此进行解答.
解答:解:(1)向茶叶灰分中加盐酸的作用是将其中的Ca2+、Al3+、Fe3+溶解,
故答案为:使Ca2+、Al3+、Fe3+等离子溶解;
(2)步骤③为过滤操作,需要用到铁架台、铁圈、铁夹、烧杯、漏斗、玻璃棒等仪器,其中属于玻璃仪器的为:烧杯、漏斗、玻璃棒,
故答案为:普通漏斗、烧杯、玻璃棒;
(3)⑤过滤后所得滤液中含Ca2+,检验Ca2+的离子方程式为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+,
故答案为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;
(4)步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,
故答案为:Fe(OH)3、Al(OH)3;
(5)步骤⑧是检验Fe3+,可加入KSCN 或NH4SCN进行检验,溶液变红色,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,
故答案为:KSCN 或NH4SCN;
(6)步骤⑨将pH值调节至4~5,此时铝离子没有沉淀而铁离子沉淀完全,步骤⑩分离后用玫瑰红物质可检验Al元素的存在,
故答案为:使Fe3+转化为Fe(OH)3沉淀;检验Al3+(或铝元素)存在.
故答案为:使Ca2+、Al3+、Fe3+等离子溶解;
(2)步骤③为过滤操作,需要用到铁架台、铁圈、铁夹、烧杯、漏斗、玻璃棒等仪器,其中属于玻璃仪器的为:烧杯、漏斗、玻璃棒,
故答案为:普通漏斗、烧杯、玻璃棒;
(3)⑤过滤后所得滤液中含Ca2+,检验Ca2+的离子方程式为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+,
故答案为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;
(4)步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,
故答案为:Fe(OH)3、Al(OH)3;
(5)步骤⑧是检验Fe3+,可加入KSCN 或NH4SCN进行检验,溶液变红色,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,
故答案为:KSCN 或NH4SCN;
(6)步骤⑨将pH值调节至4~5,此时铝离子没有沉淀而铁离子沉淀完全,步骤⑩分离后用玫瑰红物质可检验Al元素的存在,
故答案为:使Fe3+转化为Fe(OH)3沉淀;检验Al3+(或铝元素)存在.
点评:本题考查了物质性质和组成的实验探究实验分析判断,侧重于学生的分析和实验能力的考查,为高考常见题型,流程中的试剂特征和反应现象是解题关键,题目难度中等.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目