题目内容
(2009?泰州模拟)茶是我国人民喜爱的饮品.某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有钙、铁、铝三种金属元素.【部分氢氧化物完全沉淀的pH:Ca(OH)2pH≥13;Al(OH)3pH≥5.5;Fe(OH)3pH≥4.1,草酸铵[(NH4)2C2O4]是弱电解质】
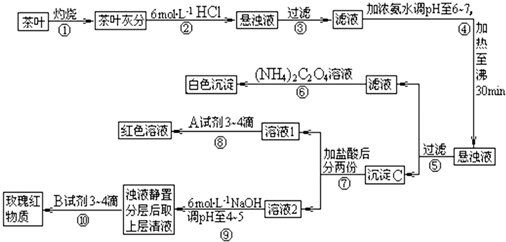
试根据上述过程及信息填空:
(1)步骤①中,使茶叶灰化需要三角架、泥三角、酒精喷灯、
(2)上述实验方案中,检出钙元素的实验步骤是
(3)步骤②中加入6mol?L-1HCl的作用是
(4)步骤⑧所用A试剂为
(5)写出步骤⑥中发生反应的离子方程式

试根据上述过程及信息填空:
(1)步骤①中,使茶叶灰化需要三角架、泥三角、酒精喷灯、
坩埚
坩埚
、坩埚钳
坩埚钳
等仪器.(2)上述实验方案中,检出钙元素的实验步骤是
⑥
⑥
,检出铁元素的实验步骤是⑧
⑧
,检出铝元素的实验步骤是⑩
⑩
(填实验步骤编号).(3)步骤②中加入6mol?L-1HCl的作用是
浸取茶叶灰分,使钙、铁、铝元素溶解
浸取茶叶灰分,使钙、铁、铝元素溶解
,步骤⑨作用是沉淀Fe3+离子,并且不影响Al3+
沉淀Fe3+离子,并且不影响Al3+
.(4)步骤⑧所用A试剂为
KSCN溶液或NH4SCN溶液
KSCN溶液或NH4SCN溶液
.(5)写出步骤⑥中发生反应的离子方程式
(NH4)2C2O4+Ca2+=CaC2O4↓+2NH4+
(NH4)2C2O4+Ca2+=CaC2O4↓+2NH4+
.分析:(1)茶叶灼烧得到灰分是在坩埚中进行,需要坩埚钳取用坩埚;
(2)步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,所以⑤过滤后所得滤液中含Ca2+,检验Ca2+的离子方程式为Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;步骤
⑧是加入硫氰酸钾溶液出现血红色证明含有铁离子;铝试剂可以对铝离子作定性检出:在醋酸及醋酸盐的弱酸性缓冲溶液(pH=4-5)中,铝离子与铝试剂生成红色络合物,流程图中步骤⑩是
检验铝元素存在的操作;
(3)依据流程图分析可知,向茶叶灰分中加盐酸的作用是将其中的Ca2+、Al3+、Fe3+溶解;步骤⑨是调节溶液PH值4-5,结合离子沉淀PH范围分析作用是把铁离子完全沉淀;
(4)步骤⑧是加入硫氰酸钾溶液检验铁离子的存在;
(5)步骤⑥中发生反应是草酸铵和钙离子形成草酸钙沉淀的反应;
(2)步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,所以⑤过滤后所得滤液中含Ca2+,检验Ca2+的离子方程式为Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;步骤
⑧是加入硫氰酸钾溶液出现血红色证明含有铁离子;铝试剂可以对铝离子作定性检出:在醋酸及醋酸盐的弱酸性缓冲溶液(pH=4-5)中,铝离子与铝试剂生成红色络合物,流程图中步骤⑩是
检验铝元素存在的操作;
(3)依据流程图分析可知,向茶叶灰分中加盐酸的作用是将其中的Ca2+、Al3+、Fe3+溶解;步骤⑨是调节溶液PH值4-5,结合离子沉淀PH范围分析作用是把铁离子完全沉淀;
(4)步骤⑧是加入硫氰酸钾溶液检验铁离子的存在;
(5)步骤⑥中发生反应是草酸铵和钙离子形成草酸钙沉淀的反应;
解答:解:(1)茶叶灼烧得到灰分是固体灼烧加热需要在坩埚中进行加热使茶叶变为灰分,取用坩埚的仪器是坩埚钳;
故答案为:坩埚、坩埚钳;
(2)步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,所以⑤过滤后所得滤液中含Ca2+,检验Ca2+的离子方程式为Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;步骤⑧是加入硫氰酸钾溶液出现血红色证明含有铁离子;铝试剂可以对铝离子作定性检出:在醋酸及醋酸盐的弱酸性缓冲溶液(pH=4-5)中,铝离子与铝试剂生成红色络合物,流程图中步骤⑩是检验铝元素存在的操作;
故答案为:⑥,⑧,⑩;
(3)流程图中加入盐酸的作用是溶解物质使钙、铁、铝元素进入溶液有利于进行离子分离;步骤⑨是调节溶液PH值4-5,结合离子沉淀PH范围可知,是用来测定铁离子且铝离子不沉淀达到分离铁离子的目的;
故答案为:浸取茶叶灰分,使钙、铁、铝元素溶解;沉淀Fe3+离子,并且不影响Al3+;
(4)依据流程图可知,步骤⑧所用A试剂是为了检验铁离子的存在,加入的是硫氰酸钾溶液和铁离子形成血红色溶液;
故答案为:KSCN溶液或NH4SCN溶液;
(5)⑤过滤后所得滤液中含Ca2+,步骤⑥中发生反应的离子方程式是检验Ca2+的存在,反应的离子方程式为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;
故答案为:(NH4)2C2O4+Ca2+=CaC2O4↓+2NH4+;
故答案为:坩埚、坩埚钳;
(2)步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,所以⑤过滤后所得滤液中含Ca2+,检验Ca2+的离子方程式为Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;步骤⑧是加入硫氰酸钾溶液出现血红色证明含有铁离子;铝试剂可以对铝离子作定性检出:在醋酸及醋酸盐的弱酸性缓冲溶液(pH=4-5)中,铝离子与铝试剂生成红色络合物,流程图中步骤⑩是检验铝元素存在的操作;
故答案为:⑥,⑧,⑩;
(3)流程图中加入盐酸的作用是溶解物质使钙、铁、铝元素进入溶液有利于进行离子分离;步骤⑨是调节溶液PH值4-5,结合离子沉淀PH范围可知,是用来测定铁离子且铝离子不沉淀达到分离铁离子的目的;
故答案为:浸取茶叶灰分,使钙、铁、铝元素溶解;沉淀Fe3+离子,并且不影响Al3+;
(4)依据流程图可知,步骤⑧所用A试剂是为了检验铁离子的存在,加入的是硫氰酸钾溶液和铁离子形成血红色溶液;
故答案为:KSCN溶液或NH4SCN溶液;
(5)⑤过滤后所得滤液中含Ca2+,步骤⑥中发生反应的离子方程式是检验Ca2+的存在,反应的离子方程式为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;
故答案为:(NH4)2C2O4+Ca2+=CaC2O4↓+2NH4+;
点评:本题考查了物质性质和组成的实验探究实验分析判断,流程中的试剂特征和反应现象是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目




 由甲苯与氯气在光照条件下反应生成,甲苯在工业上可通过下列流程获得:
由甲苯与氯气在光照条件下反应生成,甲苯在工业上可通过下列流程获得: 请在括号中填写加工方法或操作名称
请在括号中填写加工方法或操作名称 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“?”表示没有形成共价键的最外层电子,短线表示共价键.
”表示氢原子,小黑点“?”表示没有形成共价键的最外层电子,短线表示共价键.