题目内容
《实验化学》茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素.某化学研究小组欲探究茶叶中钙元素的含量(已知茶叶中的铝、铁元素对钙离子的测定有影响),设计了探究实验方案如下:
步骤1:称取250g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将100mL 2mol?L-1盐酸加入灰中搅拌、过滤、洗涤.
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6~7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,得到滤液和沉淀.
步骤3:将步骤2所得的滤液稀释至500mL,取其中的25.00mL溶液以酚酞作指示剂,用0.1000mol?L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为25.00mL,计算结果.
请回答下列问题:
(1)步骤 1中,使茶叶灰化需要的仪器有三角架、泥三角、酒精喷灯、 .
(2)步骤2中,改用试剂 来调节pH将更为方便;判断沉淀已经洗涤干净的方法是 .
(3)步骤3中,被滴定的25mL滤液中 CO32-的物质的量为 mol,
(4)原茶叶中钙离子的质量分数为 .若碳酸钠试剂不纯,且所含杂质不与Ca2+反应,则测得的钙离子的质量分数将 .
A.偏小 B.偏大 C.无影响 D.偏小或偏大或无影响.
步骤1:称取250g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将100mL 2mol?L-1盐酸加入灰中搅拌、过滤、洗涤.
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6~7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,得到滤液和沉淀.
步骤3:将步骤2所得的滤液稀释至500mL,取其中的25.00mL溶液以酚酞作指示剂,用0.1000mol?L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为25.00mL,计算结果.
请回答下列问题:
(1)步骤 1中,使茶叶灰化需要的仪器有三角架、泥三角、酒精喷灯、
(2)步骤2中,改用试剂
(3)步骤3中,被滴定的25mL滤液中 CO32-的物质的量为
(4)原茶叶中钙离子的质量分数为
A.偏小 B.偏大 C.无影响 D.偏小或偏大或无影响.
分析:(1)高温灼烧物质通常在坩埚内进行,温度很高需要用坩埚钳夹持;
(2)氢氧化钠溶液调节溶液pH,因为氢氧化铝能溶于氢氧化钠溶液,加入的氢氧化钠溶液不易控制,可以利用弱碱氨水调节溶液PH,氢氧化铝不溶于弱碱;步骤2的最终的沉淀会附着碳酸钠、氯化钠等物质,取最后的洗涤液,检验溶液是否含有碳酸根离子(或氯离子),检验碳酸根离子可以用氯化钙溶液,若无白色沉淀产生,说明洗涤干净(或用硝酸银溶液检验氯离子,若无白色沉淀产生,说明洗涤干净);
(3)步骤3中,滴定操作时,眼睛注视锥形瓶内溶液颜色变化,溶液由红色变为无色说明滴定到终点;滴定中发生反应CO32-+H+=HCO3-,根据盐酸计算被滴定的25mL滤液中 n(CO32-),进而计算500mL溶液中未反应的n(CO32-),再计算出参加反应的n(CO32-);
(4)步骤2中加入的7.95g无水碳酸钠,发生反应CO32-+Ca2+=CaCO3↓,据此计算250克干燥的茶叶含有钙元素的质量,再利用质量分数的定义计算原茶叶中钙离子的质量分数,若碳酸钠试剂不纯,且所含杂质不与Ca2+反应,不与酸反应可能测定结果偏大,与酸反应测定结果可能偏大如含有NaHCO3或含有NaOH偏小,含有不反应的物质和氢氧化钠可能不影响.
(2)氢氧化钠溶液调节溶液pH,因为氢氧化铝能溶于氢氧化钠溶液,加入的氢氧化钠溶液不易控制,可以利用弱碱氨水调节溶液PH,氢氧化铝不溶于弱碱;步骤2的最终的沉淀会附着碳酸钠、氯化钠等物质,取最后的洗涤液,检验溶液是否含有碳酸根离子(或氯离子),检验碳酸根离子可以用氯化钙溶液,若无白色沉淀产生,说明洗涤干净(或用硝酸银溶液检验氯离子,若无白色沉淀产生,说明洗涤干净);
(3)步骤3中,滴定操作时,眼睛注视锥形瓶内溶液颜色变化,溶液由红色变为无色说明滴定到终点;滴定中发生反应CO32-+H+=HCO3-,根据盐酸计算被滴定的25mL滤液中 n(CO32-),进而计算500mL溶液中未反应的n(CO32-),再计算出参加反应的n(CO32-);
(4)步骤2中加入的7.95g无水碳酸钠,发生反应CO32-+Ca2+=CaCO3↓,据此计算250克干燥的茶叶含有钙元素的质量,再利用质量分数的定义计算原茶叶中钙离子的质量分数,若碳酸钠试剂不纯,且所含杂质不与Ca2+反应,不与酸反应可能测定结果偏大,与酸反应测定结果可能偏大如含有NaHCO3或含有NaOH偏小,含有不反应的物质和氢氧化钠可能不影响.
解答:解:(1)高温灼烧物质通常在坩埚内进行,温度很高需要用坩埚钳夹持,故答案为:坩埚、坩埚钳;
(2)氢氧化钠溶液调节溶液PH,因为氢氧化铝能溶于氢氧化钠溶液,加入的氢氧化钠溶液不易控制,可以利用弱碱氨水调节溶液PH,氢氧化铝不溶于弱碱;步骤2的最终的沉淀会附着碳酸钠、氯化钠等物质,取最后的洗涤液,检验溶液是否含有碳酸根离子(或氯离子),检验方法为:取最后一次洗涤液少许于试管中,滴加CaCl2(或AgNO3)溶液,若无沉淀产生,则已洗净,
故答案为:氨水;取最后一次洗涤液少许于试管中,滴加CaCl2溶液,若无沉淀产生,则已洗净;
(3)步骤3中,滴定操作时,眼睛注视锥形瓶内溶液颜色变化,溶液由红色变为无色说明滴定到终点;滴定稀释后滤液25.00mL消耗的n(HCl)=0.025L×0.1000mol.L-1=0.0025mol,滴定中发生反应CO32-+H+=HCO3-,所以被滴定的25mL滤液中n(CO32-)=0.0025mol;
故答案为:0.0025;
(4)500mL溶液中n(CO32-)=0.0025mol×
=0.05mol,参加反应的n(CO32-)=
-0.05mol=0.025mol,步骤2中加入的7.95g无水碳酸钠,发生反应CO32-+Ca2+=CaCO3↓,由方程式可知250克干燥的茶叶含有钙元素的质量为0.025mol×40g/mol=1g,原茶叶中钙离子的质量分数为
×100%=0.4%,若碳酸钠试剂不纯,且所含杂质不与Ca2+反应,不与酸反应可能测定结果偏大,与酸反应测定结果可能偏大如含有NaHCO3或含有NaOH偏小,含有不反应的物质和氢氧化钠可能不影响,
故答案为:0.4%;D.
(2)氢氧化钠溶液调节溶液PH,因为氢氧化铝能溶于氢氧化钠溶液,加入的氢氧化钠溶液不易控制,可以利用弱碱氨水调节溶液PH,氢氧化铝不溶于弱碱;步骤2的最终的沉淀会附着碳酸钠、氯化钠等物质,取最后的洗涤液,检验溶液是否含有碳酸根离子(或氯离子),检验方法为:取最后一次洗涤液少许于试管中,滴加CaCl2(或AgNO3)溶液,若无沉淀产生,则已洗净,
故答案为:氨水;取最后一次洗涤液少许于试管中,滴加CaCl2溶液,若无沉淀产生,则已洗净;
(3)步骤3中,滴定操作时,眼睛注视锥形瓶内溶液颜色变化,溶液由红色变为无色说明滴定到终点;滴定稀释后滤液25.00mL消耗的n(HCl)=0.025L×0.1000mol.L-1=0.0025mol,滴定中发生反应CO32-+H+=HCO3-,所以被滴定的25mL滤液中n(CO32-)=0.0025mol;
故答案为:0.0025;
(4)500mL溶液中n(CO32-)=0.0025mol×
| 500 |
| 25 |
| 7.95g |
| 106g/mol |
| 1g |
| 250g |
故答案为:0.4%;D.
点评:本题考查学生对实验原理理解、实验基本操作、滴定应用、化学计算、物质含量测定等,难度中等,理解实验原理是关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中全面把握基础知识.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
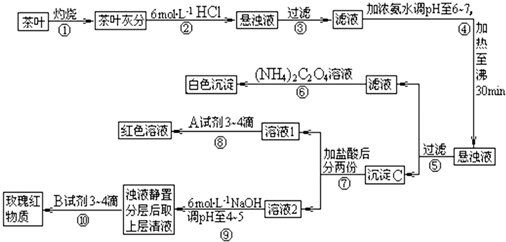
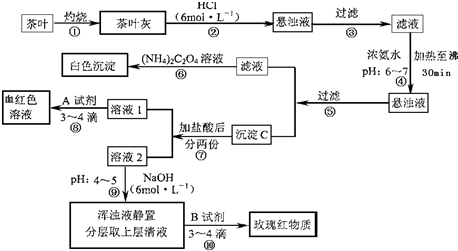
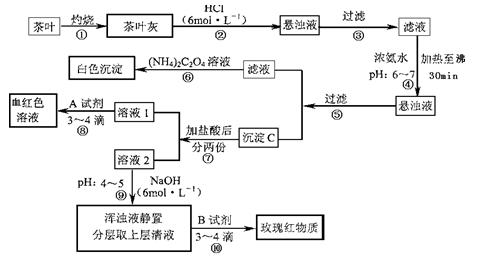
 草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、
草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、 。
。