题目内容
【题目】有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中. 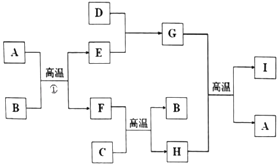
请回答下列问题:
(1)H的化学式为 .
(2)D 的电子式为 .
(3)K出反应①的化学方程式: .
(4)写出G的水溶液与C的硝酸盐溶液反应的方程式: .
【答案】
(1)Al2O3
(2)![]()
(3)3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
(4)Al3++3NH3?H2O=Al(OH)3↓+3NH4+
【解析】解:(1)由以上分析可知H为Al2O3,所以答案是:Al2O3;(2)D为N2,电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(3)铁和水反应生成四氧化三铁和氢气,方程式为3Fe+4H2O(g)
;(3)铁和水反应生成四氧化三铁和氢气,方程式为3Fe+4H2O(g) ![]() Fe3O4+4H2,所以答案是:3Fe+4H2O(g)
Fe3O4+4H2,所以答案是:3Fe+4H2O(g) ![]() Fe3O4+4H2;(4)氨水呈碱性,和硝酸铝反应生成氢氧化铝,离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+,
Fe3O4+4H2;(4)氨水呈碱性,和硝酸铝反应生成氢氧化铝,离子方程式为Al3++3NH3H2O=Al(OH)3↓+3NH4+,
所以答案是:Al3++3NH3H2O=Al(OH)3↓+3NH4+.

练习册系列答案
相关题目