题目内容
【题目】甲醇(CH3OH)有很多用途。回答下列问题:
I.甲醇可用于制取甲醛(HCHO)。
(1)甲醇的沸点为64 ℃,甲醛的沸点为-21 ℃,甲醇的沸点较高的原因是__________。
(2)甲醇分子中采用sp3杂化的原子有____________(填元素符号);甲醛分子中σ键与π键之比为_____________。
II.直接甲醇燃料电池(DMFC)因其具有质量轻、体积小、结构简单、比能量密度高、低温操作等优点,DMFC阳极普遍采用以铂(Pt)为基础 的二元催化剂,如Pt-Cr合金等。
(3)基态Cr原子的未成对电子数为______________。
(4)与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是_______。(填元素符号)
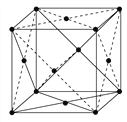
(5)已知金属铂晶胞结构如右图所示。催化剂的XRD图谱分析认为:当铂中掺入Cr原子后,Cr替代了晶胞面心位置上的Pt,该催化剂的化学式为_______,晶体中与1个Pt原子相紧邻的Cr原子有_____个。
(6)若铂原子半径为r pm,铂摩尔质量为M g·mol-1,铂晶体的密度为ρ g·cm-3,则阿伏加德罗常数NA为_____mol-1(用有关字母列出计算式即可)。
【答案】 甲醇分子间存在着氢键 C、O 3∶1 6 K、Cu PtCr3或Cr3Pt 12  (或其它合理答案)
(或其它合理答案)
【解析】I.(1)甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸点高。
(2)甲醇分子内碳原子形成4个σ键,杂化方式为sp3杂化,甲醇分子内O原子形成2个σ键,另有2对孤电子,杂化方式为sp3杂化;甲醛分子中含有1个碳氧双键,2个碳氢单键,共有3个σ键,1个π键,故为:3:1。
II.(3)Cr基态原子的价电子排布是3d54S1,所以,未成对电子有6个。
(4)24号Cr元素核外24个电子,最后6个电子的排布有两种可能:3d44s2或3d54s1。根据半满、全满规则可知后者更稳定。同理,可知同周期最外层只有1个电子的除了K,还有3d104s1的Cu。
(5)由图知,金属铂晶胞中原子为:8×![]() +6×
+6×![]() =4,当铂中掺入Cr原子后,Cr替代了晶胞面心位置上的Pt,化学式为:PtCr3或Cr3Pt;该晶胞为面心立方堆积,晶体中与1个Pt原子相紧邻的Cr原子有12个。
=4,当铂中掺入Cr原子后,Cr替代了晶胞面心位置上的Pt,化学式为:PtCr3或Cr3Pt;该晶胞为面心立方堆积,晶体中与1个Pt原子相紧邻的Cr原子有12个。
(6)面心立方结构的晶体,其配位数是12,因为以某一原子为原点,离它最近的(即第一近邻)有12个原子,故答案为:12;铂晶体为面心立方最密堆积,则每个晶胞中含有铂的原子:8×![]() +6×
+6×![]() =4,铂原子半径为r pm=r×10-10cm,晶体铂的密度为ρg·cm-3,晶胞的边长为d,
=4,铂原子半径为r pm=r×10-10cm,晶体铂的密度为ρg·cm-3,晶胞的边长为d, ![]() d=4r,d=2
d=4r,d=2![]() r pm=2
r pm=2![]() ×r×10-10cm,晶胞的体积是d3,则ρd3=
×r×10-10cm,晶胞的体积是d3,则ρd3=![]() ,即:ρ(2
,即:ρ(2![]() ×r×10-10)3=
×r×10-10)3=![]() ,解得:NA=
,解得:NA= 。
。

【题目】全钒液流电池(简称钒电池)是一种新型酸性硫酸盐电池。回答下列问题:
I.钒电池原理如图所示:
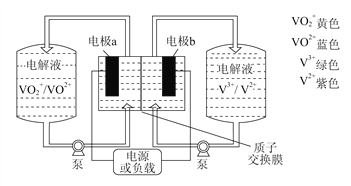
(1)当放电时右槽溶液颜色逐渐由紫变绿,电极b为____极。电极a反应式为________。
(2)充电过程中,若转移0.5 mol电子,质子交换膜左侧电解液中n(H+)的变化量为__________。
II.钒电池失效后,废电解液的回收利用的一种工艺如下:

已知:①+5价钒在溶液中存在如下平衡:VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
②部分含钒物质在水中的溶解性见下表:
物质 | VOSO4 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 易溶 |
(3)氧化工序中,其它价态的钒全部氧化成VO2+,完成V2+氧化的离子方程式:______
V2++ ClO3-+ _____= VO2++ Cl-+ ____
(4)氧化工序中,NaClO与NaClO3均可用作氧化剂,不选择NaClO的理由是_____
(5)浓缩工序中,加入NaOH的作用是___________
(6)沉钒工序的化学方程式为_____________
(7)煅烧偏钒酸铵时,固体质量随温度变化的曲线如下图所示。加热到100 ℃ ~ 200 ℃时,产生的一种气体是_______(填分子式);加热到400 ℃时,得到的固体产物是______(填名称)。


