题目内容
12.下列有关实验叙述正确的是( )| A. | 除去苯中混有的苯酚可加入浓溴水后过滤 | |
| B. | 向淀粉溶液中滴加稀硫酸后,加热,再加入新制Cu(OH)2加热,没有出现红色沉淀,说明淀粉没有发生水解反应 | |
| C. | 向NaOH溶液中加入溴乙烷,加热,再加入AgNO3溶液,产生沉淀,说明溴乙烷发生了水解反应 | |
| D. | 向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液褪色,说明维生素C有还原性 |
分析 A.苯是一种良好的有机溶剂,溴、苯酚以及三溴苯酚都能溶于苯中;
B.水解后溶液显酸性,检验葡萄糖应在碱性条件下;
C.溴乙烷与NaOH溶液共热后,直接加入硝酸银,未排除氢氧根的干扰,生成氢氧化银也是难溶于水的沉淀;
D.维生素C有还原性,能使酸性高锰酸钾溶液褪色.
解答 解:A.加浓溴水,生成三溴苯酚,三溴苯酚和溴都能与苯互溶,不能将二者分离,并引入新的杂质,故A错误;
B.水解后溶液显酸性,检验葡萄糖应在碱性条件下,则水解后应加碱至碱性,再加入少量新制Cu(OH)2浊液,加热,观察是否生成砖红色沉淀,分析水解程度,故B错误;
C.溴乙烷与NaOH溶液共热后,直接加入硝酸银,未排除氢氧根的干扰,生成氢氧化银也是难溶于水的沉淀,不能说明是氯化银沉淀,故C错误;
D.维生素C有还原性,能使酸性高锰酸钾溶液褪色,故D正确.
故选D.
点评 本题主要考查的是常见有机物的性质以及检验,把握官能团与性质的关系为解答的关键,题目难度不大.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目
11.“嫦娥一号”成功发射,标志着我国实施绕月探测工程迈出重要一步.其任务之一是探测月球土壤厚度、探明氦(${\;}_{2}^{3}$He)储量.下列有关氦-3(${\;}_{2}^{3}$He)的说法中正确的是( )
| A. | ${\;}_{2}^{3}$He原子核内含有2个中子 | |
| B. | ${\;}_{2}^{3}$He原子核内含有3个质子 | |
| C. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的核素 |
7.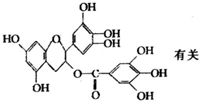 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )
 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )| A. | EGCG的分子式为C22H18O11 | |
| B. | EGCG在空气中易氧化,也能与溴水发生加成反应 | |
| C. | 1molEGCG最多可与含9mol氢氧化钠的溶液完全作用 | |
| D. | EGCG能与碳酸钠溶液反应,但不能放出二氧化碳 |
17.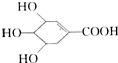 八角、茴香中含有一种抗亚川禽流感病毒的重要成分莽草酸,它的结构简式如图:下列关于莽草酸的说法中正确的是( )
八角、茴香中含有一种抗亚川禽流感病毒的重要成分莽草酸,它的结构简式如图:下列关于莽草酸的说法中正确的是( )
 八角、茴香中含有一种抗亚川禽流感病毒的重要成分莽草酸,它的结构简式如图:下列关于莽草酸的说法中正确的是( )
八角、茴香中含有一种抗亚川禽流感病毒的重要成分莽草酸,它的结构简式如图:下列关于莽草酸的说法中正确的是( )| A. | 该化合物的分子中处于同一平面的原子只有4个 | |
| B. | 该化合物能发生消去反应,不能发生酯化反应 | |
| C. | 该化合物属于多元醇类物质,不能使溴水褪色 | |
| D. | 该化合物只有酸性,不具有碱性 |
4.A、B都是短周期元素,原子半径B>A,它们可形成化合物AB2,由此可以得出的正确判断是( )
| A. | 原子序数:A大于B | B. | A和B可能在同一主族 | ||
| C. | A可能在第2周期ⅣA族 | D. | A肯定是金属元素 |
2.下列平衡体系在体积不变时,加入所给物质,平衡可以发生移动的是( )
| A. | 在FeCl3(aq)+KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq) 平衡体系中,加入KCl晶体 | |
| B. | 在N2(g)+3H2(g)?2NH3(g) 平衡体系中,通入HCl气体 | |
| C. | 在CaCO3(s)?Ca2+(aq)+CO32-(aq)平衡体系中,加入CaCO3固体 | |
| D. | 在2SO2(g)+O2(g)?2SO3(g) 平衡体系中,通入N2 |
 绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
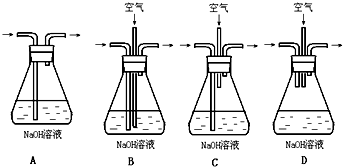
绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究: 某同学在实验室研究SO2的性质(夹持装置省略,装置内的空气已排除)
某同学在实验室研究SO2的性质(夹持装置省略,装置内的空气已排除)