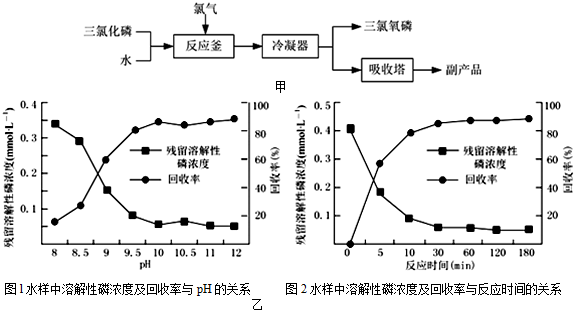
题目内容
7.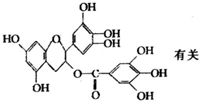 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )| A. | EGCG的分子式为C22H18O11 | |
| B. | EGCG在空气中易氧化,也能与溴水发生加成反应 | |
| C. | 1molEGCG最多可与含9mol氢氧化钠的溶液完全作用 | |
| D. | EGCG能与碳酸钠溶液反应,但不能放出二氧化碳 |
分析 由EGCG的结构式可知,分子中含酚-OH、-COOC-、-COC-,结合苯酚、酯的性质来解答.
解答 解:A.EGCG的分子中含有22个C原子、18个H原子、11个O原子,分子式应为C22H18O11,故A正确;
B.不含碳碳双键,与溴水不发生加成反应,故B错误;
C.酚羟基可与NaOH反应,-COO-在碱性条件下水解生成-COONa,1mol EGCG最多能与含9mol氢氧化钠的溶液发生反应,故C正确;
D.含有酚羟基,酸性不碳酸弱,与碳酸钠反应生成碳酸氢钠,故D正确.
故选B.
点评 本题考查有机物的结构和性质,题目难度中等,注意把握常见有机物的官能团的性质,本题易错点为有机物的分子式,注意观察.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
6.将纯水加热至较高温度,下列叙述正确的是( )
| A. | Kw变大、pH变小、呈酸性 | B. | Kw变大、pH不变、呈中性 | ||
| C. | Kw变小、pH变大、呈碱性 | D. | Kw变大、pH变小、呈中性 |
7.下列说法正确的是( )
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 生石灰与水混合的过程只发生物理变化 | |
| C. | O3是由3个氧原子构成的化合物 | |
| D. | CuSO4•5H2O是一种混合物 |
15.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,常用于水的消毒以及纺织高漂白.过氧化氢法生产亚氯酸钠的流程图如下

已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O且NaClO2在碱性条件下稳定性较高.试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O.
(2)在稳定装置中生成NaClO2,H2O2作B(选填序号).
A.氧化剂 B.还原剂 C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
反应生成NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.
(3)在实验室模拟“固体分离装置”中的技术(即从溶液中分离出溶质),必须进行的实验操作是BEA(按实验先后顺序填写操作代号).
A.过滤 B.加热 C.分液 D.蒸馏 E.冷却 F.萃取
(4)经查阅资料知道:①当pH≤2.0时,ClO2-能被I-完全还原成Cl-;
②溶液中能发生反应:2S2O32-+I2=2I-+S4O62-.
欲测定成品中NaClO2的含量,现进行如下操作:
①步骤Ⅱ中发生反应的离子方程式是ClO2-+4H++4I-=2I2+Cl-+2H2O,
②步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×10{\;}^{-2}VC}{4W}$(用有关字母表示).
(5)ClO2是新型饮用水消毒剂,Cl2常用于饮用水消毒.等物质的量的物质,ClO2的消毒效率是Cl2的2.5倍.

已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O且NaClO2在碱性条件下稳定性较高.试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O.
(2)在稳定装置中生成NaClO2,H2O2作B(选填序号).
A.氧化剂 B.还原剂 C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
反应生成NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.
(3)在实验室模拟“固体分离装置”中的技术(即从溶液中分离出溶质),必须进行的实验操作是BEA(按实验先后顺序填写操作代号).
A.过滤 B.加热 C.分液 D.蒸馏 E.冷却 F.萃取
(4)经查阅资料知道:①当pH≤2.0时,ClO2-能被I-完全还原成Cl-;
②溶液中能发生反应:2S2O32-+I2=2I-+S4O62-.
欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取NaClO2样品Wg,加水配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol•L-1的 Na2S2O3溶液滴定 |
②步骤Ⅲ中达到滴定终点时的现象是滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×10{\;}^{-2}VC}{4W}$(用有关字母表示).
(5)ClO2是新型饮用水消毒剂,Cl2常用于饮用水消毒.等物质的量的物质,ClO2的消毒效率是Cl2的2.5倍.
12.下列有关实验叙述正确的是( )
| A. | 除去苯中混有的苯酚可加入浓溴水后过滤 | |
| B. | 向淀粉溶液中滴加稀硫酸后,加热,再加入新制Cu(OH)2加热,没有出现红色沉淀,说明淀粉没有发生水解反应 | |
| C. | 向NaOH溶液中加入溴乙烷,加热,再加入AgNO3溶液,产生沉淀,说明溴乙烷发生了水解反应 | |
| D. | 向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液褪色,说明维生素C有还原性 |
19.根据CH2=C(CH3)CH2COOH的结构,可知它不可能具有的性质是( )
| A. | 使溴的四氯化碳溶液褪色 | |
| B. | 与银氨溶液反应析出银 | |
| C. | 与新制Cu(OH)2反应 | |
| D. | 与乙醇在浓硫酸催化下发生酯化反应 |
16.已知25℃时,电离平衡常数Ka(HF)=3.6×10-4 mol/L,溶度积常数Ksp(CaF2)=1.46×10-10 mol3/L3.现向1L 0.2mol/L HF溶液中加入1L 0.2mol•L-1 CaCl2溶液,则下列说法中,正确的是( )
| A. | 25℃时,0.1 mol/L HF溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 该体系中,Ksp(CaF2)=$\frac{1}{{K}_{a}HF}$ | |
| D. | 该体系中有CaF2沉淀产生 |
17.已知一种c(H+)=1×10-3mol•L-1的酸和一种c(OH-)=1×10-3mol•L-1的碱溶液等体积混合后,溶液呈酸性,其原因可能是( )
| A. | 浓的强酸和稀的强碱溶液反应 | B. | 浓的弱酸和稀的强碱溶液反应 | ||
| C. | 等浓度的强酸和弱碱溶液反应 | D. | 生成一种强酸弱碱盐 |