题目内容
2.下列平衡体系在体积不变时,加入所给物质,平衡可以发生移动的是( )| A. | 在FeCl3(aq)+KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq) 平衡体系中,加入KCl晶体 | |
| B. | 在N2(g)+3H2(g)?2NH3(g) 平衡体系中,通入HCl气体 | |
| C. | 在CaCO3(s)?Ca2+(aq)+CO32-(aq)平衡体系中,加入CaCO3固体 | |
| D. | 在2SO2(g)+O2(g)?2SO3(g) 平衡体系中,通入N2 |
分析 A、铁离子和硫氰根离子生成硫氰酸铁络离子形成的化学平衡,Fe3++3SCN-=Fe(SCN)3,加入KCl晶体,对平衡无影响;
B、N2(g)+3H2(g)?2NH3(g),通入HCl气体和氨气结合生成固体氯化铵,平衡正向进行;
C、固体对平衡无影响;
D、平衡体系在体积不变时,通入N2,对反应无响应.
解答 解:A、FeCl3(aq)+KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq),是铁离子和硫氰根离子交换生成硫氰酸铁络离子形成的化学平衡,Fe3++3SCN-=Fe(SCN)3,加入KCl晶体,对平衡无影响,故A不符合;
B、N2(g)+3H2(g)?2NH3(g),通入HCl气体和氨气结合生成固体氯化铵,平衡正向进行,故B符合;
C、CaCO3(s)?CaO(s)+CO2(g),加入CaCO3 是固体对平衡无影响,故C不符合;
D、平衡体系在体积不变时,2SO2(g)+O2(g)?2SO3(g),通入N2,总压增大,分压不变,平衡不动,故D不符合;
故选B.
点评 本题考查了化学平衡影响因素分析判断,把握平衡移动原理是关键,题目较简单,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
12.下列有关实验叙述正确的是( )
| A. | 除去苯中混有的苯酚可加入浓溴水后过滤 | |
| B. | 向淀粉溶液中滴加稀硫酸后,加热,再加入新制Cu(OH)2加热,没有出现红色沉淀,说明淀粉没有发生水解反应 | |
| C. | 向NaOH溶液中加入溴乙烷,加热,再加入AgNO3溶液,产生沉淀,说明溴乙烷发生了水解反应 | |
| D. | 向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液褪色,说明维生素C有还原性 |
13.下列电子式或结构式正确的是( )
| A. | HCl 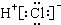 | B. | NaCl 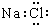 | C. | HClO H-Cl-O | D. | CO2 O=C=O |
10.一元强酸和一元强碱恰好完全中和时,它们一定相等的是( )
| A. | 体积 | B. | 质量 | ||
| C. | 物质的量浓度 | D. | H+和OH-的物质的量 |
17.已知一种c(H+)=1×10-3mol•L-1的酸和一种c(OH-)=1×10-3mol•L-1的碱溶液等体积混合后,溶液呈酸性,其原因可能是( )
| A. | 浓的强酸和稀的强碱溶液反应 | B. | 浓的弱酸和稀的强碱溶液反应 | ||
| C. | 等浓度的强酸和弱碱溶液反应 | D. | 生成一种强酸弱碱盐 |
7.NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A. | 标准状况下,2.24 L CCl4中含有的分子数大于0.1NA | |
| B. | 常温下,1 mol/L Na2CO3溶液中阴离子总数大于0.1NA | |
| C. | 分子数为NA的C2H4气体体积约为22.4 L,该条件一定是标准状况 | |
| D. | 标准状况下,4.2 g C3H6中含有的碳碳双键数一定为0.1 NA |
11.在一定条件下,下列有机物都能发生加成反应、取代反应、水解反应和中和反应共四种反应的是( )
| A. | 一滴香: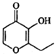 | B. | 芬必得: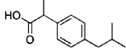 | ||
| C. | 维生素B5: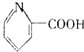 | D. | 扑热息痛: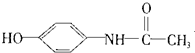 |
12.化学与科学、技术、社会和环境密切相关.下列说法正确的是( )
| A. | 电解时电解池的阳极一定是阴离子放电 | |
| B. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行:则该反应的△H>0 | |
| C. | 其他条件不变,增大压强,平衡可能移动,但平衡常数一定不变 | |
| D. | 铁制品表面镶锌块和铁制品表面镀锡,都能起到防腐的作用且防腐原理是相同的 |