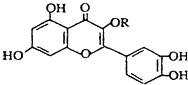
��Ŀ����
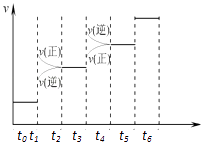
����Ŀ����֪��������һ����Ҫ�����ȼ�ϣ�����ͨ��CH3OH���Ӽ���ˮ�Ƶã�2CH3OH��g��CH3OCH3��g��+H2O��g����H=23.5kJmol��1 �� ��T1�棬�����ܱ������н�������ƽ�⣬��ϵ�и����Ũ����ʱ��仯��ͼ��ʾ����ش��������⣺ 
��1���������·�Ӧƽ�ⳣ������ʽK= �� ��t1��ʱ����Ӧ��ƽ�ⳣ��Ϊ �� ��CH3OH��ʾ�Ļ�ѧ��Ӧ���� ��
��2����ͬ�����£����ı���ʼŨ�ȣ�ijʱ�̸����Ũ������Ϊc��CH3OH��=0.4molL��1��c��H2O��=0.6molL��1��c��CH3OCH3��=1.2molL��1 �� ��ʱ�����淴Ӧ���ʵĴ�С��v ������v ���棩�����������������=������
���𰸡�
��1��![]() ��5��
��5��![]() mol/��L?min��
mol/��L?min��
��2����
���������⣺��1�����ڿ��淴Ӧ2CH3OH��g��CH3OCH3��g��+H2O��g����ƽ�ⳣ��Ϊ��K= ![]() ��
��
��ͼ��֪����t1minʱ����ƽ�⣬ƽ��ʱCH3OH��CH3OCH3��H2OŨ�ȷֱ�Ϊ0.4mol/L��1mol/L��0.8mol/L����ƽ�ⳣ��K= ![]() =
= ![]() =5��
=5��
��CH3OH��ʾ�Ļ�ѧ��Ӧ����Ϊ��v��CH3OH��= ![]() =
= ![]() mol/��Lmin����
mol/��Lmin����
���Դ��ǣ� ![]() ��5��
��5�� ![]() mol/��Lmin����
mol/��Lmin����
��2.����ʱ��Ũ����Qc= ![]() =4.5��С��ƽ�ⳣ��5���ʷ�Ӧ������Ӧ���У���v ��������v ���棩��
=4.5��С��ƽ�ⳣ��5���ʷ�Ӧ������Ӧ���У���v ��������v ���棩��
���Դ��ǣ�����
�����㾫�������ڱ��⿼��Ļ�ѧƽ��ļ��㣬��Ҫ�˽ⷴӦ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%���ܵó���ȷ�𰸣�

 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�