题目内容
【题目】在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是 ( )
CH3COO-+H+对于该平衡,下列叙述正确的是 ( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
【答案】B
【解析】试题分析:A、加水促进醋酸的电离,平衡正向移动,A错误;B、加入少量NaOH固体,溶液的酸性减弱,平衡正向移动,B正确;C、加入少量0.1 mol·L-1盐酸,溶液中的c(H+)增大,抑制醋酸电离,C错误;D、加入少量CH3COONa固体时,醋酸根离子浓度增大,平衡逆向移动,D错误。答案选B。

【题目】利用硫铁矿焙烧的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
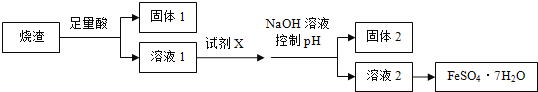
已知部分阳离子以氢氧化物形式沉淀时溶液的pH 见下表:
沉淀物 | F e(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)试剂X应选用________________。
(2)控制pH 的范用_________________。
(3)从溶液2得到FeSO4·7H2O 产品的过程中,须控制条作防止其氧化和分解,检验FeSO4溶液是否变质的方法是______________。
(4) 利用溶液1还可制备一种新型高效净水剂——聚合硫酸铝铁[Al2Feb(OH)m(SO4)n·xH2O],为了测定某种聚合硫酸铝铁的组成,进行如下实验:
步骤一:准确称取8.810g 样品溶于150mL0.100mol·L-1稀硫酸,恰如完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体10.485g;
步骤二:另取相同质量的样品,溶于过量的氢碘酸,充分搅拌反应后,以0.500mol·L-1 Na2S2O3溶液滴定至浅黄色,滴入几滴淀粉溶液,继续滴定至终点,消耗Na2S2O3溶液20.00mL。
(已知:I2+2Na2S2O3=2NaI+Na2S4O6 )
通过计算确定该聚合硫酸铝铁的化学式______________。(写出计算过程)