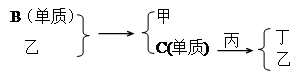题目内容
在下列物质转化关系中,反应的条件和部分产物已略去。
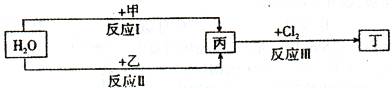
回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅰ是工业制盐酸的反应。
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,
则工业上生产甲的一般方法是_ 。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应a的化学方程式是
③通过比较反应I、II的反应条件,可得出甲的金属性比乙的金属性_ (填“强”或“弱”)。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应II是化合反应。目前常用乙作为燃煤的脱硫剂,则乙脱硫的主要反应的化学方程
式是
②在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。其反应的离
子方程式是

回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅰ是工业制盐酸的反应。
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,
则工业上生产甲的一般方法是_ 。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应a的化学方程式是
③通过比较反应I、II的反应条件,可得出甲的金属性比乙的金属性_ (填“强”或“弱”)。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应II是化合反应。目前常用乙作为燃煤的脱硫剂,则乙脱硫的主要反应的化学方程
式是
②在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。其反应的离
子方程式是
17.(2)①C; ②3Fe+4H2O(g)=Fe3O4+4H2(g);③强;(2)①CaO + SO2 = CaSO3 +2CaSO4; ②2Cl2 + H2O + CaCO3 = Ca2+ + 2Cl- + 2HClO + CO2
试题分析:工业制备盐酸的反应,丙为H2,丁为HCl,(1)反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,该物质含有Na元素,故甲为Na,与水反应生成氢氧化钠,工业上制备钠采用电解法,故选C。②反应II中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙为Fe,处于周期表中第四周期第Ⅷ族,生成的磁性物质为Fe3O4,反应方程式为:3Fe+4H2O(g)=Fe3O4+4H2(g),故答案为:第四周期第Ⅷ族;3Fe+4H2O(g)=Fe3O4+4H2(g);③铁越水蒸气在高温条件下发生反应,钠与水在常温下剧烈反应,故金属性钠比铁强,最高价氧化物对应水化物碱性强弱比较金属性强弱,NaOH是强碱而Fe(OH)3是弱碱,说明金属性钠比铁强,故答案为:强;NaOH是强碱而Fe(OH)3是弱碱;
(2)①燃煤的脱硫剂,主要是把二氧化硫吸收,目前主要是方法是石灰石脱硫法,方程式如答案所示。②在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体应该是二氧化碳,方程式如答案所示。

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目