题目内容
【题目】锂离子电池是一种二次电池,它主要依靠锂离子在两极之间移动来工作.某锂离子电池正极材料有钴酸锂(LiCoO2)、铝箔和有机物导电剂等.现利用以下流程回收正极材料中的某些资源. 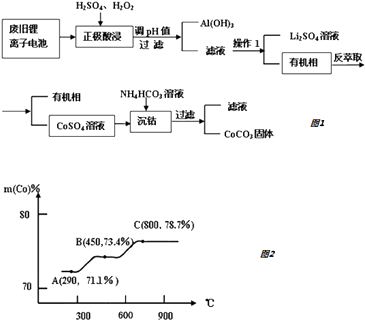
请回答下列问题:
(1)用硫酸和过氧化氢酸浸时,一般在90℃下进行,写出该步骤中LiCoO2参与的化学反应方程式 . 当有1mol LiCoO2参加反应时,得到氧化产物的质量为 .
(2)常温条件下调pH时,若使Al3+完全沉淀所需最小的pH为(保留整数).
(已知:①离子浓度等于或小于1.×10﹣6时,认为其完全沉淀; ②Al(OH)3的Ksp=1.13×10﹣33)
(3)操作1的名称是 .
(4)从平衡角度进行解释生成CoCO3固体的原因 .
(5)钴元素与铁元素都属于第 VIII族,它们的化合物有相似的性质.Co(OH)2在空气中加热时,钴元素在固体残留物中的百分含量有如右图所示的变化.已知钴的氢氧化物加热至290℃时已完全脱水,则A点时,剩余固体的成分为(填化学式);在550﹣600℃范围内,剩余固体的成分为(填化学式).
【答案】
(1)2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+O2↑+4H2O;16g
(2)5
(3)萃取分液
(4)HCO3﹣存在电离平衡:HCO3﹣?H++CO32﹣ , 当电离产生的CO32﹣浓度与溶液中Co2+浓度的积(即浓度积)大于CoCO3的Ksp时,对于溶解平衡:CoCO3(S)?Co2+(aq)+CO32﹣(aq)而言,平衡将向生成沉淀的方向移动
(5)Co2O3;CoO、Co3O4
【解析】解:(1)根据工艺流程中酸浸的过程中发生氧化还原反应有2LiCoO2+3 H2SO4+H2O2=Li2SO4+2 CoSO4+O2↑+4H2O,2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+O2↑+4H2O中氧化产物是氧气,1molLiCoO2完全反应生成氧气0.5mol,其质量为16g,
所以答案是:2LiCoO2+3H2SO4+H2O2=Li2SO4+2CoSO4+O2↑+4H2O;16g;(2)离子浓度等于或小于1.0×10﹣6时,认为其完全沉淀;(OH﹣)3= ![]() =
= ![]() ,c(OH﹣)=10﹣9 molL﹣1 , c(H+)=
,c(OH﹣)=10﹣9 molL﹣1 , c(H+)= ![]() mol/L=10﹣9 molL﹣1 , pH=5,
mol/L=10﹣9 molL﹣1 , pH=5,
所以答案是:5;(3)该操作是萃取、分液,操作1的名称是萃取分液,
所以答案是:萃取分液;(4)平衡移动原理,溶液中HCO3﹣H++CO32﹣ Co2+浓度与CO32﹣ 浓度积即为浓度积大于CoCO3的Ksp 向生成沉淀的方向移动,
所以答案是:HCO3﹣存在电离平衡:HCO3﹣H++CO32﹣ , 当电离产生的CO32﹣浓度与溶液中Co2+浓度的积(即浓度积)大于CoCO3的Ksp时,对于溶解平衡:CoCO3(S) Co2+(aq)+CO32﹣(aq)而言,平衡将向生成沉淀的方向移动;(5)钴元素与铁元素都属于第 VIII族,它们的化合物有相似的性质,Co(OH)2在空气中加热时,根据FeFe的氧化物,则Co的氧化物可能为Co2O3、CoO、Co3O4 , Co2O3中Co的含量= ![]() ×100%=71.1%、CoO中Co的含量=
×100%=71.1%、CoO中Co的含量= ![]() ×100%=78.7%、Co3O4中Co的含量=
×100%=78.7%、Co3O4中Co的含量= ![]() ×100%=73.4%,
×100%=73.4%,
所以A点成分为Co2O3 , 在550﹣600℃范围内,剩余固体的成分为Co3O4和CoO,
所以答案是:Co2O3;CoO、Co3O4 .

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
