题目内容
【题目】某兴趣小组为探究铁和浓硫酸反应的产物及性质,用如图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验). 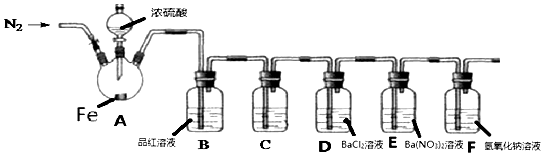
实验开始前,先打开弹簧夹通一段时间N2 , 关闭弹簧夹后,在A中滴加一定量的浓硫酸,观察实验现象,然后加热,观察到A中有白雾生成,铁片上有气泡产生.已知A中白雾是硫酸与水形成的酸雾.请回答下列问题:
(1)铁片上滴入浓硫酸未加热前没有明显现象的原因是 .
(2)加热一段时间后发现B装置中溶液褪色,取出A中的溶液少许,加入KSCN溶液未出现血红色,写出此时A中反应的化学方程式: .
(3)C装置的作用是除去二氧化硫气体中硫酸蒸汽,则盛放的溶液是 .
A.水
B.NaOH溶液
C.Na2SO3
D.NaHSO3溶液
(4)实验开始前,先通一段时间N2的目的是 .
(5)可以证明H2SO3是弱酸的实验装置是 .
(6)E中的白色沉淀是 , 该沉淀的生成表明SO2具有性.
(7)装置F的作用是 , 写出该装置中反应的化学方程式 .
【答案】
(1)铁表面生成致密氧化膜或铁发生钝化
(2)Fe+2H2SO4(浓) ![]() FeSO4+SO2↑+2H2O
FeSO4+SO2↑+2H2O
(3)D
(4)除去装置内的空气(或氧气),防止二氧化硫被氧化
(5)D
(6)BaSO4;还原
(7)尾气处理,防止污染空气;2NaOH+SO2=Na2SO3+H2O
【解析】解:(1)铁片上滴入浓硫酸未加热前没有明显现象的原因是铁表面生成致密氧化膜或铁发生钝化,
所以答案是:铁表面生成致密氧化膜或铁发生钝化;(2)由上述分析可知,A中反应的化学方程式Fe+2H2SO4(浓) ![]() FeSO4+SO2↑+2H2O,
FeSO4+SO2↑+2H2O,
所以答案是:Fe+2H2SO4(浓) ![]() FeSO4+SO2↑+2H2O; (3)A、B、C均与二氧化硫反应,只有D除去硫酸且不除去二氧化硫,
FeSO4+SO2↑+2H2O; (3)A、B、C均与二氧化硫反应,只有D除去硫酸且不除去二氧化硫,
所以答案是:D;(4)实验开始前,先通一段时间N2的目的是除去装置内的空气(或氧气),防止二氧化硫被氧化,
所以答案是:除去装置内的空气(或氧气),防止二氧化硫被氧化;(5)可以证明H2SO3是弱酸的实验装置是D,D中无现象,可知盐酸的酸性大于亚硫酸的酸性,
所以答案是:D; (6)E中的白色沉淀是BaSO4,该沉淀的生成表明SO2具有还原性,所以答案是:BaSO4; 还原;(7)装置F的作用是尾气处理,防止污染空气,该装置中反应的化学方程式为2NaOH+SO2=Na2SO3+H2O,所以答案是:尾气处理,防止污染空气;2NaOH+SO2=Na2SO3+H2O.

 名校课堂系列答案
名校课堂系列答案【题目】某研究性学习小组同学对由NaHCO3和KHCO3组成的某均匀混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
试计算:
(1)混合物与盐酸反应的离子方程式;
(2)盐酸的物质的量浓度 ;
(3)混合物中两物质的物质的量之比 .



