题目内容
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是:( )
A.当有0.1 mol电子转移时,a极产生标准状况下1.12 L H2
B.左端装置中化学能转化为电能,右端装置中电能转化为化学能
C.c极上发生的电极反应是:O2 + 2H2O+ 4e- = 4OH—
D.d极上进行还原反应,右端装置B中的H+可以通过隔膜进入A
A
解析试题分析:依据图示知左边装置是电解池,右边装置是原电池,ab电极是电解池的电极,由电源判断a为阴极产生的气体是氢气,b为阳极产生的气体是氧气;cd电极是原电池的正负极,c是正极,d是负极;电解池中的电极反应为:b电极为阳极失电子发生氧化反应:4OH--4e-=2H2O+O2↑;a电极为阴极得到电子发生还原反应:4H++4e-=2H2↑;原电池中是酸性溶液,电极反应为:d为负极失电子发生氧化反应:2H2-4e-=4H+;c电极为正极得到电子发生还原反应:O2+4H++4e-=2H2O,则A、当有0.1 mol电子转移时,a电极为原电池正极,电极反应为4H++4e-=2H2↑,产生1.12LH2,故A正确;B、左端装置中电能转化为化学能,右端装置中化学能转化为电能,B不正确;C、c电极为正极得到电子发生还原反应:O2+4H++4e-=2H2O,C不正确;D、d为负极失电子发生氧化反应:2H2-4e-=4H+,B池中的H+可以通过隔膜进入A池,故D不正确,答案选A。
考点:考查电化学原理的应用与判断

 阅读快车系列答案
阅读快车系列答案如图所示的两个实验装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间后,测得导线上均通过0.02 mol电子,若不考虑溶液体积的变化,则下列叙述中正确的是
| A.产生气体的体积:(1)> (2) |
| B.电极上析出物质的质量:(1)> (2) |
| C.溶液pH的变化:(1)增大,(2)减小 |
| D.电极反应式:(1)中阳极:4OH--4e-===2H2O+O2↑,(2)中负极:2H++2e-===H2↑ |
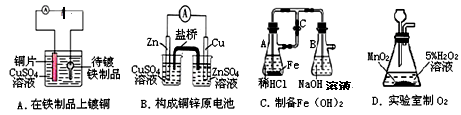
某小组为研究原电池原理,设计如图装置,下列叙述正确的是
| A.装置I,铜片上有O2逸出 |
| B.装置I,锌片溶解,发生还原反应 |
| C.装置II,电池反应为:Zn+ Cu2+= Zn2++ Cu |
| D.装置II,外电路中,电子从锌电极流向铜电极 |
关于如图所示各装置的叙述中,正确的是
| A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| B.装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+ |
| C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
| D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
下列有关电池的说法不正确的是
| A.手机上用的锂离子电池属于二次电池 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.甲醇燃料电池可把化学能转化为电能 |
| D.锌锰干电池中,锌电极是负极 |
下列与金属腐蚀有关的说法正确的是
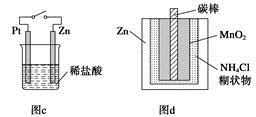
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,CuZn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,ZnMnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 |
| B.金属护拦表面涂漆 |
| C.汽车底盘喷涂高分子膜 |
| D.地下钢管连接镁块 |
为防止钢铁锈蚀,下列防护方法中正确的是( )
| A.在精密机床的铁床上安装铜螺钉 |
| B.在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中 |
| C.在海轮舷上用铁丝系住锌板浸在海水里 |
| D.在电动输油管的铸铁管上接直流电源的正极 |