��Ŀ����
����Ŀ���������������������ʴ��ÿ����ʴ����ʧ�ĸֲ�ռ���������������ķ�֮һ��
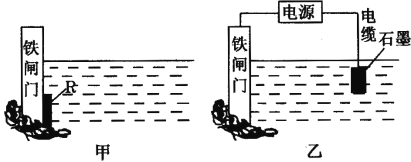
(1)������ʴ��Ҫ��������ʴ���ø�ʴ�����еĵ缫��ӦʽΪ��������_____________________________ ��������______________________��
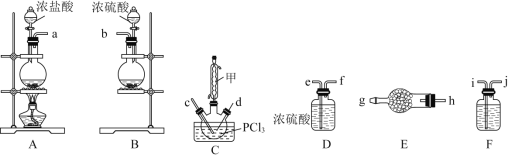
(2)Ϊ�˽���ijˮ����բ�ű���ʴ�����ʣ����Բ��ü�ͼ��ʾ�ķ��������к�����բ ���ϵĹ������R���Բ���___________��
A��ͭ B���� C��п D��ʯī
(3)��ͼ��ʾ�ķ���Ҳ���Խ�����բ�ŵĸ�ʴ���ʣ�������բ��Ӧ��������ֱ����Դ��___________����
(4)Ǧ�����ǻ�ѧ��Դ����缫���Ϸֱ�ΪPb��PbO2���������ҺΪϡ���ᣬ�ŵ�ʱ��ص��ܷ�ӦΪPb + PbO2 + 2H2SO4== 2PbSO4 + 2H2O��������������жϣ�
��Ǧ���ص�����������_______(����Pb������PbO2��)�������ĵ缫��ӦʽΪ_______________________________________��
��Ǧ���ع���ʱ���������Һ��SO42������________��(����������������)����Һ��pH___________ (��������������С������������)��
���𰸡�O2 + 2H2O + 4e��= 4 OH�� Fe - 2e�� = Fe2+ C �� PbO2 Pb + SO42- - 2e��== PbSO4 �� ����
��������
(1)������ʴ��Ҫ��������ʴ���ø�ʴ�����еĵ缫��ӦʽΪ������������ԭ��Ӧ��������O2 + 2H2O + 4e��= 4 OH�� ����������������Ӧ��������Fe - 2e�� = Fe2+��
(2)Ӧ������Ƴ�ԭ��ص���������Ϊ���������õĽ�����ѡ����п���ԣ����������ƣ�������ˮ�������ҷ�Ӧ����������������ʴ��Ч������ѡC��
(3)ͼ����ʾ�ķ���Ϊ��ӵ�Դ�������������������ӵ�Դ�ĸ�����
(4)Ǧ�����ǻ�ѧ��Դ����缫���Ϸֱ�ΪPb��PbO2���������ҺΪϡ���ᣬ�ŵ�ʱ��ص��ܷ�ӦΪPb + PbO2 + 2H2SO4== 2PbSO4 + 2H2O��������������жϣ�
��Ǧ���ص�����������PbO2 �������ĵ缫��ӦʽΪPb + SO42- - 2e��== PbSO4 ��
��Ǧ���ع���ʱ��SO42���������ӣ��������Һ��SO42��������Pb + PbO2 + 2H2SO4== 2PbSO4 + 2H2O��Ӧ�������������ᣬ��Һ��pH����

 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�