题目内容
【题目】25°C时,向10mL0.10mol·L-1的一元弱酸HA(Ka =1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( )
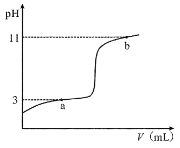
A.a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在a点和b点时水的电离程度相同
C.b点时,c(Na+)=c(HA)+c(A- )+c(OH-)
D.V =10mL时,c(Na+)>c(A-)>c(H+)>c(HA)
【答案】A
【解析】
A.a点时,pH=3,c(H+) = 10-3 mol·L-1,因为Ka =1.0×10-3,所以c(HA) = c(A—),根据电荷守恒c(A—) + c(OH—) = c(Na+) + c(H+)和c(HA) = c(A—)即得c(HA)+c(OH-)=c(Na+)+c(H+),故A正确;
B.a点溶质为HA和NaA,pH=3,水电离出的c(OH—)=10—11;b点溶质为NaOH和NaA,pH=11,c(OH—) = 10-3,OH—是由 NaOH电离和水电离出两部分之和组成的,推断出由水电离处的c(OH—)<10-3,那么水电离的c(H+)>10—11,故B错误;
C.根据电荷守恒c(Na+) + c(H+) = c(A—) + c(OH—)可得c(Na+) = c(A—) + c(OH—)-c(H+),假设C选项成立,则c(A—) + c(OH—)-c(H+) = c(HA) + c(A— ) + c(OH—),推出c(HA) + c(H+) = 0,故假设不成立,故C错误;
D.V =10mL 时,HA与NaOH恰好完全反应生成NaA,A—+ H2O HA +OH—,水解后溶液显碱性,c(OH—) > c(H+), 即c(HA) > c(H+) ,故D错误;
故答案选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】钛广泛应用于航天、军事、化工、医疗等领域。钛在高温下易和氧、氮、碳等元素化合,提炼纯钛条件苛刻。从高钛渣![]() 主要为
主要为![]() 提炼海绵钛流程如下:
提炼海绵钛流程如下:

氯化后的粗![]() 中含有
中含有![]() 、
、![]() 、
、![]() 、
、![]() 等杂质,相关物质的沸点如下表:
等杂质,相关物质的沸点如下表:
化合物 |
|
|
|
|
|
沸点 | 136 | 310 |
| 180 | 138 |
回答下列问题:
![]() 高钛渣经过破碎、磁选、磨粉后送氯化车间,磨粉的目的是________。
高钛渣经过破碎、磁选、磨粉后送氯化车间,磨粉的目的是________。
![]() “分馏
“分馏![]() ,原因是________。加入铝粉使
,原因是________。加入铝粉使![]() 转化为
转化为![]() 便于除去,写出铝粉与
便于除去,写出铝粉与![]() 反应的化学方程式:________。
反应的化学方程式:________。
![]() “除铝”的方法是用水湿润的活性炭加入到粗
“除铝”的方法是用水湿润的活性炭加入到粗![]() ,使
,使![]() 转化为________而除去。
转化为________而除去。
![]() “还原”需要在Ar的气氛中进行,原因是________。副产物经电解生成________可循环使用。
“还原”需要在Ar的气氛中进行,原因是________。副产物经电解生成________可循环使用。
![]() 制备钛的一种新型方法是:将
制备钛的一种新型方法是:将![]() 粉末浇注成形,烧结后作阴极,以石墨为阳极,
粉末浇注成形,烧结后作阴极,以石墨为阳极,![]() 为熔盐进行电解
为熔盐进行电解![]() 熔盐不参与电极反应,起溶解和传导
熔盐不参与电极反应,起溶解和传导![]() 的作用
的作用![]() 。
。
![]() 阳极生成的气体除
阳极生成的气体除![]() 外,还有________
外,还有________![]() 填化学式
填化学式![]() 。
。
![]() 阴极的电极反应式为________。
阴极的电极反应式为________。