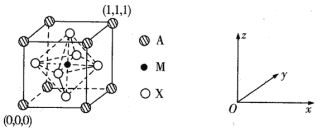
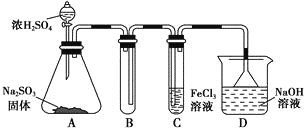
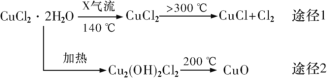题目内容
【题目】向一定量的铜和 Fe2O3 的混合物中加入 200mL1.5 mol·L-1的稀硫酸,完全反应后固体无剩余,得到的溶液中只有两种溶质,假设反应前后溶液体积不变,则下列说法正确的是( )
A.原混合物中 Cu 和 Fe2O3 的质量之比为 1∶2
B.反应后的溶液中 CuSO4 的物质的量的浓度为 1mol/L
C.若用 CO 还原等质量的原混合物,充分反应后,质量将减少 4.8 克
D.该反应过程均发生氧化还原反应
【答案】C
【解析】
在溶液中发生以下反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Cu+ Fe2(SO4)3=CuSO4+2FeSO4;“完全反应后固体无剩余,得到的溶液中只有两种溶质”,则溶液中的溶质为CuSO4、FeSO4,且二者满足物质的量之比为1:2关系。
A.依据以上分析,n(CuSO4):n(FeSO4)=1:2,则原混合物中Cu 和Fe2O3的物质的量之比为 1∶1,质量比为64:160=2:5,A不正确;
B.n(CuSO4):n(FeSO4)=1:2,依据SO42-守恒,反应后的溶液中CuSO4的物质的量浓度为 ![]() =0.5mol/L,B不正确;
=0.5mol/L,B不正确;
C.原混合物与硫酸反应,生成硫酸盐和水,n(H2SO4)=0.3mol,则原混合物中含O原子0.3mol,若用 CO 还原等质量的原混合物,减少的质量等于混合物所含氧的质量,即为0.3mol×16g/mol=4.8g,C正确;
D. 该反应过程中,Fe2O3+3H2SO4=Fe2(SO4)3+3H2O为非氧化还原反应,D错误。
故选C。

【题目】实验室有NaHSO4、Ba(OH)2、NH3·H2O、NaHCO3、KAl(SO4)2五种无色溶液,现欲通过它们之间的相互反应的现象对其进行鉴别。部分物质间的反应现象如表。
A | B | C | D | E | |
A | ↓ | ||||
B | ↑ | ↓ | |||
C | ↑ | ↑↓ | ↓ | ||
D | ↓ | ↑↓ | ↓ | ||
E | ↓ | ↓ | ↓ |
表中“↑”表示生成气体物质,“↓”表示生成沉淀。根据以上信息,回答以下问题。
(1)B,E的化学式分别为________、________。
(2)写出A的电离方程式:_____________。