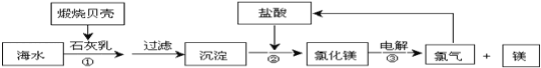
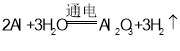题目内容
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4LCCl4中含原子总数为5NA
B.物质的量浓度为0.5![]() MgCl2溶液中,含有Cl—数目为NA
MgCl2溶液中,含有Cl—数目为NA
C.常温常压下,NA个CO2分子占的体积大于22.4L
D.3.2g由氧气和臭氧组成的混合物中含有氧气分子的数目为0.1NA
【答案】C
【解析】
A. 标况下,CCl4为液态,无法根据体积计算其物质的量,故A错误;
B. 只知道浓度,体积未知,无法计算溶液中溶质的多少,故B错误;
C. 常温常压下,气体摩尔体积大于22.4L/mol,NA个CO2分子占的体积大于22.4L,故C正确;
D. 氧气和臭氧均是由氧原子构成,故3.2g混合气体中含有的氧原子的物质的量0.2mol,但氧气分子的物质的量无法确定,分子数目也无法确定,故D错误;
故选C。

【题目】Ⅰ.已知某可逆反应:aA(g)+bB(g) ![]() cC(g)+dD(g)。请回答下列问题:
cC(g)+dD(g)。请回答下列问题:
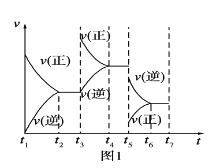
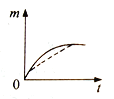
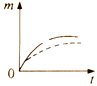
(1)根据实验测定结果,描绘出了该反应达到平衡状态时及改变外界条件后,反应速率与时间的关系图像(如图1所示),有利于提高D产量的变化过程是图像中的______段;引起该变化过程的外界条件是_________________________________________。
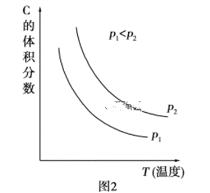
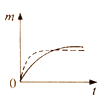
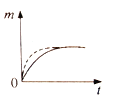
(2)根据实验测定结果描绘出了图2。由此图像可以得出,升高温度,上述平衡将向____(填“正反应”或“逆反应”)方向移动;反应计量数之间的关系:a+b______c+d(填“大于”、“小于”、“等于”或“不确定”)。
Ⅱ.工业合成氨反应如下:N2+3H2![]() 2NH3。请回答下列问题:
2NH3。请回答下列问题:
(1)在一定条件下2L的密闭容器中进行实验,并测得下列数据:
物质 | N2 | H2 | NH3 |
起始(mol) | 2 | 7 | 0 |
10s(mol) | 1.6 | ||
平衡时(mol) | 2 |
则10s内,用氢气表示的化学反应速率是______,该反应的化学平衡常数是________。
(2)根据混合气体各成分的物质性质,你认为工业上将氨气从混合气体中分离出来的措施是________,从而达到反应气体循环利用的目的。实验室检验氨气的方法是__________。