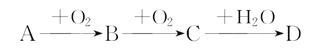��Ŀ����
����Ŀ��ijʵ��С��ͬѧ�Ե绯ѧԭ��������һϵ��̽�����
��1����ͼΪijʵ��С������������ԭ��Ӧ��(�����ӷ���ʽ��ʾ) �� ��Ƶ�ԭ���װ�ã���Ӧǰ���缫������ȣ�һ��ʱ������缫�������12 g��������ͨ��mol���ӡ�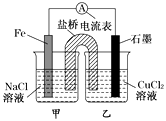
��2��������������Ƭ������Һ���������Թ��У������еμ��������Ʊ�����ˮ��д��������Ӧ�����ӷ���ʽ �� Ȼ��μӼ������軯����Һ����Һ��죬�����μӹ������Ʊ�����ˮ����ɫ��ȥ��ͬѧ�ǶԴ����˶��ּ��裬ijͬѧ�ļ����ǣ�����Һ�еģ�3����������Ϊ���ߵļ�̬���������3����������ΪFeO ![]() ����д���÷�Ӧ�����ӷ���ʽ��
����д���÷�Ӧ�����ӷ���ʽ��
��3����ͼ�����������䣬�������Ż�����ͭ������ʯī������n�ͣ���ͼ��ʾ��һ��ʱ����ڼ�װ��ͭ˿�����μӷ�̪��Һ����������Һ��죬�缫��ӦΪ����װ����ʯī(1)Ϊ��(���������������������������)����װ������ͭ˿����ʯī�缫�Ϸ����ķ�ӦʽΪ��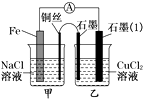
��4���۲���ͼ��ʾ������װ�ã�ͼ1װ����ͭ�缫�ϲ�����������ɫ���ݣ�ͼ2װ����ͭ�缫������������������缫�ϲ�����������ɫ���塣���������������Ʋ���������е�������Ҫ��ѧ����Ϊ����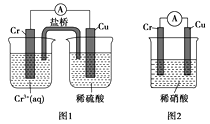
���𰸡�
��1��Fe��Cu2��=Fe2����Cu,0.2
��2��2Fe2����Cl2=2Fe3����2Cl��, 2Fe3����3Cl2��8H2O=2FeO42����6Cl����16H��
��3��O2��2H2O��4e��=4OH��,��,2Cl����2e��=Cl2��
��4���������Ļ�Ա�ͭ��ǿ���ܺ�ϡ���ᷴӦ����H2,�������ױ�ϡ����ۻ�
����������1��ͼ1Ϊԭ��ط�Ӧ��FeΪ������������Fe-2e��=Fe2+��ʯīΪ����������Cu2��+2e��=Cu���ܷ�ӦʽΪFe+Cu2���TFe2��+Cu��һ��ʱ������缫�������12g����
Fe+Cu2���TFe2��+ | Cu | �����������m | ת�Ƶ��� |
56g+64g=120g | 2mol | ||
12g | n |
��ã�n=0.2mol��
��2��������������Ƭ������Һ��FeΪ������������Fe-2e��=Fe2+�������еμ��������Ʊ�����ˮ��������Fe2�������� 2Fe2����Cl2=2Fe3����2Cl�� �������3����������ΪFeO42�����䷴Ӧ�����ӷ���ʽΪ��2Fe3��+3Cl2+8H2O=2FeO42��+6Cl��+16H����
��3����ͼ�����������䣬�������Ż�����ͭ������ʯī������n�ͣ���װ��Ϊ����������ʴ����Ϊ������ͭΪ�������������� O2+2H2O+4e���T4OH�����ʼ��ԣ��μӷ�̪����Һ��죬����װ������������ʯīΪ��������ͭ������ʯīΪ�����������ķ�ӦΪ��2Cl����2e��=Cl2����
��4����ͼ1��֪��ԭ��Cr��Cu���������Ļ�Ա�ͭ��ǿ���ܺ�ϡ���ᷴӦ����H2������ϡ������ȴ�����˷��������ϡ����������ԣ������Ʋ����ϡ����ۻ������»��Խ��ͣ��ʴ�Ϊ���������Ļ�Ա�ͭ��ǿ���ܺ�ϡ���ᷴӦ����H2���������ױ�ϡ����ۻ���
��1�������Է�������ԭ��Ӧ֪ʶ����д��������������Ӧ������������仯���м��㣻
��2�������������ӱ�����������д���ӷ���ʽ�����������ӱ�����Ϊ�������������д���ӷ���ʽ��
��3�����ݵ��ء�ԭ��صĹ���ԭ�����лش�
��4�����ݽ�����ǿ�����з���.