��Ŀ����
����Ŀ���⻯����һ����ɫ���塣������ˮ��ʵ�����Ʊ�KI����IJ�������:
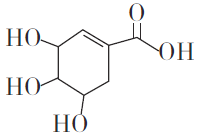
I.����ͼ��ʾ��������ƿ�м���127g��ϸ�ĵ���I2��195g30%KOH��Һ������(��֪:I2��KOH��Ӧ����֮һ��KIO3)��
II.����ȫ��Ӧ��Һ©���еĻ��������ɼУ���װ��C��ͨ��������H2S��
III.��Ӧ��������װ��C�м���ϡH2SO4�ữ,ˮԡ���ȣ�
IV.��ȴ�����˵�KI����Һ��
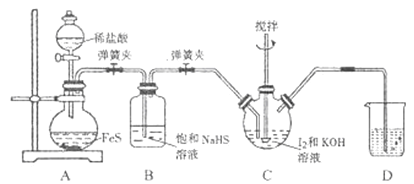
(1)���װ��A�����Եķ�����______������I����KOH��Һ������Ŀ����______��
(2)װ��B��������______��װ��D��ʢ�ŵ���Һ��______ ��
(3)д��װ��C��H2S��KIO3��Ӧ�����ӷ���ʽ: ______ ��
(4)����III��ˮԡ���ȵ�Ŀ���dz�ȥ______ (�ѧʽ)��
(5)�ɲ���IV���õ�KI����Һ(��SO42-)�Ʊ�KI�����ʵ�鷽��:�߽��������Һ�м���������______ (�ѧʽ����ͬ),��ֽ��衢���ˡ�ϴ�Ӳ������,����Һ��ϴ��Һ�ϲ�,����HI��Һ����������,�ڲ��Ͻ������������϶��������,ֹͣ����,����������,�õ�KI���塣�ڲⶨ��Ʒ��KI����ʱ,����京��Ϊ101.5%,��ԭ������Dz�Ʒ�к���______��
���𰸡� ��Һ©��ע��ˮ��,�رյ��ɼ�,��Һ©������ʹҺ�����£�һ��ʱ���Һ�岻��˳������,˵������������ ȷ�����ַ�Ӧ ��ȥH2S�����е�HCl ����������Һ IO3-+3H2S=3S��+I-+3H2O H2S BaCO3 I2(��KI3)
��������(1)���Aװ�õ������Է���Ϊ����Һ©��ע��ˮ�����رյ��ɼ�����Һ©������ʹҺ�����£�һ��ʱ���Һ�岻��˳��������˵�����������ã�KOH��Һ�����ɱ�֤I2���ʳ�ַ�Ӧ����߲��ʣ��ʴ�Ϊ��ȷ�����ַ�Ӧ��
(2)�����ӷ�������NaHS��Һ��������HCl���岢ͬʱ����H2S���壬��B�������dz�ȥH2S�����е�HCl��H2S�����ж���Ⱦ��������D��ʢ�ŵ���NaOH��Һ����ȥ������H2S���塣
(3) H2S���л�ԭ�ԣ�KIO3���������ԣ����߷���������ԭ��Ӧ��IO3-����ԭΪI-�����ӷ���ʽΪ��IO3-+3H2S=3S��+I-+3H2O��
(4) ����III����Һ�к�������ˮ��H2S��ˮԡ���ȿ��Խ�H2S�ϳ����������ʣ��ʴ�Ϊ������III��ˮԡ���ȵ�Ŀ���dz�ȥH2S��
(5)KI�к���K2SO4�����Լ��벻����ˮ��BaCO3���彫SO42-ת��ΪBaSO4������K2CO3��Ȼ���������HI�ٽ�CO32-��ȥ���ʴ�ΪBaCO3���ⶨ��Ʒ��KI����ʱ��KI�ĺ���ƫ�ߣ������Ǽ��ȹ����У�����I-������ΪI2���ʣ�����ΪI2+KI=KI3��I2���ʻ�KI3���ڲ�Ʒ�У����µ�Ԫ�غ������Ӷ�KI�ĺ���ƫ�ߣ��ʴ�ΪI2(��KI3)��

 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д� Ʒѧ˫�ž�ϵ�д�
Ʒѧ˫�ž�ϵ�д� Сѧ��ĩ���100��ϵ�д�
Сѧ��ĩ���100��ϵ�д�����Ŀ����ͼͼ���У�������Ϊ����������ʵ�����������Ϊ����Һ�м��뷴Ӧ������ʵ���������Ӧ��ͼ������루1������4����Ӧ���� 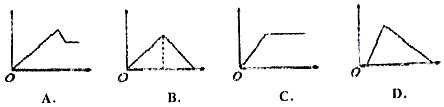
��Һ | �������� | ��Ӧ��ͼ�� |
�ű���ʯ��ˮ | ͨ����CO2���� | |
���Ȼ�����Һ | ���������ˮ | |
��MgCl2��AlCl3�Ļ��Һ | ��μ���NaOH��Һ������ | |
�Ⱥ�����NaOH��NaAlO2��Һ | ��μ���ϡ���� |