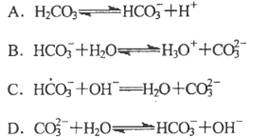
题目内容
常温下向四份0.1 mol·L-1的醋酸钠溶液中分别加入少量冰醋酸、硫酸氢钠固体、醋酸钠固体、氢氧化钠固体(忽略溶液体积及温度变化),则溶液中c(Ac-)/c(Na+)变化正确的是
| A.增大、增大、不变、减小 |
| B.增大、减小、增大、减小 |
| C.减小、增大、增大、减小 |
| D.增大、减小、不变、减小 |
B
试题分析:在CH3COONa=CH3COO-+Na+。溶液中存在水解平衡:CH3COO-+H2O
 CH3COOH+OH-。所以c(Ac-)/c(Na+)<1.当向溶液中加入少量冰醋酸时,c(CH3COOH)增大,c(CH3COO-)增大,所以c(Ac-)/c(Na+)增大;当向溶液中加入少量硫酸氢钠固体时NaHSO4=Na++H++SO42-。电离产生的H+对水解平衡起促进作用,使c(CH3COO-)减小,所以c(Ac-)/c(Na+)减小;当向溶液中加入少量醋酸钠固体时,盐电离产生的CH3COO-使溶液中的c(CH3COO-)增大,c(Ac-)/c(Na+)增大;当向溶液中加入少量氢氧化钠固体时,NaOH=Na++OH-,c(OH-)增大,使水解平衡受到抑制,使c(CH3COO-)减小,所以c(Ac-)/c(Na+)减小。因此正确选项为B。
CH3COOH+OH-。所以c(Ac-)/c(Na+)<1.当向溶液中加入少量冰醋酸时,c(CH3COOH)增大,c(CH3COO-)增大,所以c(Ac-)/c(Na+)增大;当向溶液中加入少量硫酸氢钠固体时NaHSO4=Na++H++SO42-。电离产生的H+对水解平衡起促进作用,使c(CH3COO-)减小,所以c(Ac-)/c(Na+)减小;当向溶液中加入少量醋酸钠固体时,盐电离产生的CH3COO-使溶液中的c(CH3COO-)增大,c(Ac-)/c(Na+)增大;当向溶液中加入少量氢氧化钠固体时,NaOH=Na++OH-,c(OH-)增大,使水解平衡受到抑制,使c(CH3COO-)减小,所以c(Ac-)/c(Na+)减小。因此正确选项为B。
练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目