题目内容
【题目】下列有关化学合物(F)的合成路线如下:
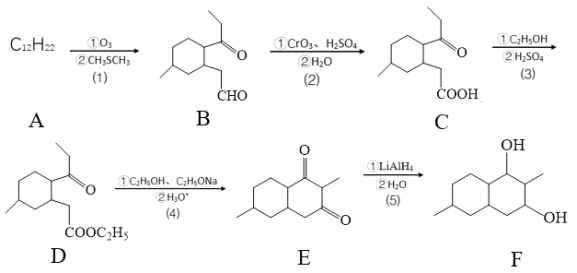
已知: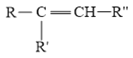
![]()
 +R″-CHO
+R″-CHO
回答下列问题:
(1)化合物D官能团的名称是_________________。
(2)反应⑸的反应类型是____________。
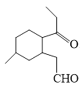
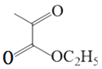
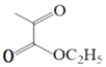
(3)化合物A的键线式是____________。
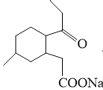
(4)化合物B与新制的Cu(OH)2悬浊液反应的化学方程:____________。
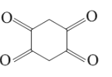
(5)碳原子上连有4个不同的原子或原子团,该碳称为手性碳,则化合物C的手性碳原子数有____个。
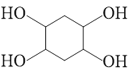
(6)芳香化合物G是化合物E的同分异构体,且G满足以下两个条件:
①1molG与足量金属钾反应,在标准状况下放出22.4LH2;
②有三种不同化学环境的氢原子且它们的原子个数比为6:2:1。
则G可能的结构简式____________。
⑺设计由![]() 制备
制备 的合成路线________。
的合成路线________。
【答案】酯基、羰基 还原反应或加成反应 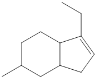
 +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
 +Cu2O↓+3H2O 3
+Cu2O↓+3H2O 3 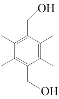
![]()
![]()
![]()
【解析】
由信息:![]()
![]()
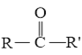 +R″-CHO,分析B的结构,可得A为:
+R″-CHO,分析B的结构,可得A为: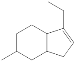 ,B
,B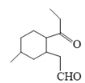 中醛基被氧化为羧基得到C
中醛基被氧化为羧基得到C ,C与乙醇发生酯化反应得D
,C与乙醇发生酯化反应得D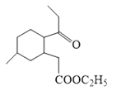 ,D中酯基与羰基的α-H反应形成圆环,生成E
,D中酯基与羰基的α-H反应形成圆环,生成E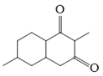 ,E在NaBH4作用下还原成F
,E在NaBH4作用下还原成F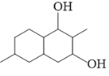 。
。
(1)化合物D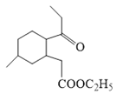 官能团的名称是酯基、羰基。故答案为:酯基、羰基;
官能团的名称是酯基、羰基。故答案为:酯基、羰基;
(2)E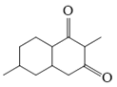 在NaBH4作用下还原成F
在NaBH4作用下还原成F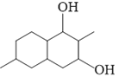 ,反应⑸的反应类型是还原反应或加成反应。故答案为:还原反应或加成反应;
,反应⑸的反应类型是还原反应或加成反应。故答案为:还原反应或加成反应;
(3)由信息: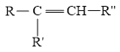
![]()
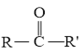 +R″-CHO,分析B的结构,可得化合物A的键线式是
+R″-CHO,分析B的结构,可得化合物A的键线式是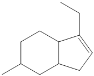 。故答案为:
。故答案为: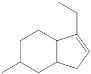 ;
;
(4)化合物B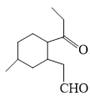 与新制的Cu(OH)2悬浊液反应,醛基被氧化为羧酸盐,化学方程:
与新制的Cu(OH)2悬浊液反应,醛基被氧化为羧酸盐,化学方程: +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
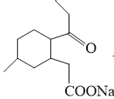 +Cu2O↓+3H2O。故答案为:
+Cu2O↓+3H2O。故答案为: +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
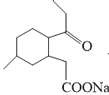 +Cu2O↓+3H2O;
+Cu2O↓+3H2O;
(5)碳原子上连有4个不同的原子或原子团,该碳称为手性碳,则化合物C的手性碳原子数有3个,如图: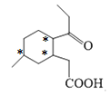 。故答案为:3;
。故答案为:3;
(6)芳香化合物G是化合物E 的同分异构体,且G满足以下两个条件:①1molG与足量金属钾反应,在标准状况下放出22.4LH2,说明有两个羟基;②有三种不同化学环境的氢原子且它们的原子个数比为6:2:1,说明分子结构对称,将除苯环外的碳和氧均分为两份,分布在对称轴的两侧。则G可能的结构简式
的同分异构体,且G满足以下两个条件:①1molG与足量金属钾反应,在标准状况下放出22.4LH2,说明有两个羟基;②有三种不同化学环境的氢原子且它们的原子个数比为6:2:1,说明分子结构对称,将除苯环外的碳和氧均分为两份,分布在对称轴的两侧。则G可能的结构简式 。
。
故答案为: ;
;
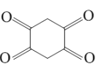
⑺对产物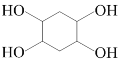 联想到E到F的反应,应合成
联想到E到F的反应,应合成 ,根据D合成E的思路可由
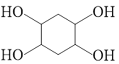
,根据D合成E的思路可由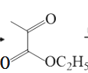 合成,对比原料
合成,对比原料![]() 用乙醇酯化即可。设计由
用乙醇酯化即可。设计由![]() 制备
制备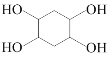 的合成路线:
的合成路线: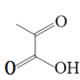
![]()
![]()
![]()
 。
。
故答案为: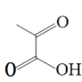
![]()

![]()
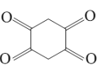
![]()
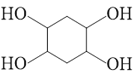 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】工业上用钛精矿(主要成分TiO2,矿粉中含有Fe,Al,Si,V等氧化物)制备海绵钛的基本思路是:氯化法生产TiCl4、还原、真空蒸馏法制备海绵钛(Ti)。
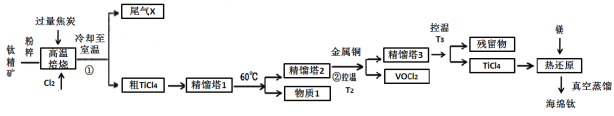
已知:①氯化过程中,其他元素均转化为最高价氯化物;
②热还原过程中,可能会有副产物TiCl3;
③常见物质熔沸点
化合物 | TiCl4 | SiCl4 | FeCl3 | AlCl3 | VOCl3 | VOCl2 | MgCl2 | Ti | Mg |
沸点 | 136 | 56 | 308 | 180(升华) | 134 | 168 | 1412 | 3260 | 1090 |
熔点 | -69 | -25 | 304 | 190 | -78.9 | —— | 712 | 1668 | 648.9 |
回答下列问题:
(1)将钛精矿粉粹的目的是:_______________
(2)氯化过程中,TiO2发生的化学方程式①是:_____________
(3)物质1是________,步骤②中金属铜的作用是将VOCl3还原成VOCl2,其目的是_____________;
(4)工业上常用Mg或H2作还原剂,在Ar气氛下采用热还原法制海绵钛。
①镁不足时,TiCl4会因有副产物产生而导致产率会下降,副反应的化学方程式为_____________;此处采用真空蒸馏法除去海绵钛中的Mg和MgCl2,不采用常压蒸馏的原因是_______。
②根据图象,计算1173K时,反应2H2+TiCl4 =Ti+4HCl的△G=_________。
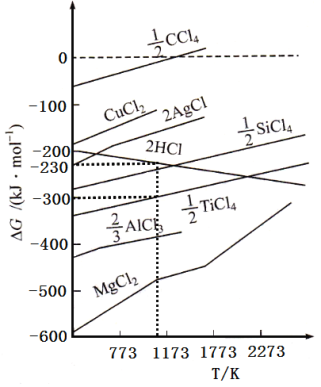
(G为自由能,图中△G是指在一定温度下,由单质生成对应物质的量化合物时的自由能变化。设此温度下,单质的生成自由能变化为0)