题目内容
短周期主族元素A、B、C、D原子序数依次增大。已知:A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
- A.原子半径:A< D< B < C
- B.A的氢化物稳定性大于C的氢化物稳定性
- C.A在自然界中只能以化合态形式存在
- D.D的单质可使干燥的红色布条褪色
B
A、C的原子序数的差为8,说明两元素同族,最外层电子数相等
设B的最外层电子数为x,则A与C元素的最外层电子数均为2x,则2x+2x+x=15,得x=3,说明AC分别为第VIA族的O、S元素,而B为Al元素,D只能为Cl元素
A:四元素中铝元素的层数最多且核电荷数最小,故铝的半径最大,排除
B:O的非金属性较S强,氢化物稳定性相对较强,正确
C:氧气就是氧元素的游离状态,不正确
D:干燥的氯气并没有漂白性,排除
答案为B
A、C的原子序数的差为8,说明两元素同族,最外层电子数相等
设B的最外层电子数为x,则A与C元素的最外层电子数均为2x,则2x+2x+x=15,得x=3,说明AC分别为第VIA族的O、S元素,而B为Al元素,D只能为Cl元素
A:四元素中铝元素的层数最多且核电荷数最小,故铝的半径最大,排除
B:O的非金属性较S强,氢化物稳定性相对较强,正确
C:氧气就是氧元素的游离状态,不正确
D:干燥的氯气并没有漂白性,排除
答案为B

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
短周期主族元素A、B、C、D的原子序数依次增大.A、C原子序数相差8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
| A、原子半径:A<D<C<B | B、B、C、D分别与A形成的化合物一定含有相同的化学键 | C、最高价氧化物对应水化物的酸性:D<C | D、常温下,单质B能大量溶于浓硝酸中 |
短周期主族元素A、B、C的原子序数依次递增,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,它们原子的最外层电子数之和为10,则下列叙述正确的是( )
| A、原于半径A<B<C | B、A的气态氢化物稳定性大于C的气态氢化物稳定性 | C、A、C两元素最高价氧化物均可与水化合得到对应的酸 | D、高温时,A单质可以从C的氧化物中置换得到C单质 |
短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体.下列推断中正确的是( )
| A、原子半径由小到大的顺序:r(C)<r(D)<r(E) | B、元素D、E分别与A形成的化合物的热稳定性:E>D | C、元素D的最高价氧化物对应水化物的酸性比E的强 | D、元素B分别与A、C形成的化合物中化学键的类型完全相同 |
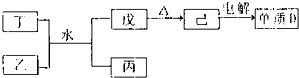
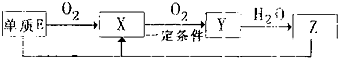
 短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物.
短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物. NH3?H2O+H+
NH3?H2O+H+ 2NO2
2NO2