题目内容
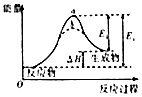
【题目】已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)(正反应为放热反应).现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭容器中,反应物物质的量随时间变化关系如图所示,则下列说法错误的是( ) 
A.前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(Lmin)
B.反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g)
C.若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g)
D.a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d
【答案】A
【解析】解:由图可知0﹣10min平衡状态时,X曲线△c=(0.6﹣0.2)mol/L=0.4mol/L,Y曲线△c=(0.6﹣0.4)mol/L=0.2mol/L,X曲线浓度变化量是Y曲线浓度变化量的2倍,则X曲线表示NO2浓度随时间的变化曲线,Y曲线表示N2O4浓度随时间的变化曲线;反应时NO2浓度增大,N2O4浓度减小,说明反应逆向进行; A.前10min内用NO2表示的化学反应速率v(NO2)= ![]() =
= ![]() =0.04mol/(Lmin),故A错误;
=0.04mol/(Lmin),故A错误;
B.反应进行至25min时,c(NO2)增大、c(N2O4)不变,所以改变的条件可能是向容器中添加NO2(g),故B正确;
C.若要达到与最后相同的化学平衡状态,在25min时还可以增大生成物平衡逆向移动来实现,故C正确;
D.如果各物质的浓度不变时,该可逆反应达到平衡状态,根据图知,bd点各物质浓度不变,说明正逆反应速率相等,反应达到平衡状态,故D正确;
故选A.
由图可知0﹣10min平衡状态时,X曲线△c=(0.6﹣0.2)mol/L=0.4mol/L,Y曲线△c=(0.6﹣0.4)mol/L=0.2mol/L,X曲线浓度变化量是Y曲线浓度变化量的2倍,则X曲线表示NO2浓度随时间的变化曲线,Y曲线表示N2O4浓度随时间的变化曲线;反应时NO2浓度增大,N2O4浓度减小,说明反应逆向进行;
A.前10min内用NO2表示的化学反应速率v(NO2)= ![]() ;
;
B.反应进行至25min时,c(NO2)增大、c(N2O4)不变;
C.若要达到与最后相同的化学平衡状态,在25min时还可以增大生成物平衡逆向移动;
D.如果各物质的浓度不变时,该可逆反应达到平衡状态.