题目内容
【题目】常温下,青蒿素是一种无色针状晶体,易溶于有机溶剂,难溶于水,熔点约为156.5℃,易受湿、热的影响而分解。某实验小组对青蒿素的提取和组成进行了探究。
Ⅰ.提取流程:

⑴ “破碎”的目的是_______________________________________。
⑵ 操作a和操作b的名称分别是_________、___________。
⑶ 操作a用到的玻璃仪器有玻璃棒、_____________________。
⑷ 操作a所用青蒿必须干燥且不宜加热,原因是_______________________________。
Ⅱ.燃烧法测定最简式:
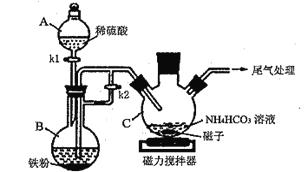
实验室用下图所示装置测定青蒿素(烃的含氧衍生物)中氧元素的质量分数。

⑸ 实验前至少称量_________个质量数据。
⑹ 装置D中所盛固体可以是____(用对应符号填空);(a.生石灰 b.CaCl2 c.CuSO4 d.碱石灰)
F的作用是_______________________________________。
⑺ A中固体分别用MnO2、KMnO4时产生等量O2,消耗H2O2的物质的量之比为______。(生成的O2全部放出,与KMnO4反应的H2O2经过酸化)
⑻ 燃烧m g青蒿素,图中D、E的质量分别增重a g、b g,则青蒿素中氧元素的质量分数可表示为_________________(只写计算式,用含有m、a、b的符号来表示,不化简)。
【答案】扩大接触面积,便于青蒿素被乙醚浸出 过滤 蒸馏 漏斗、烧杯 青蒿素易受湿、热的影响而分解 3 b 防止空气中的H2O和CO2被E吸收而影响实验结果 2∶1(或2) ![]() ×100%
×100%
【解析】
Ⅰ.根据乙醚浸取法的流程可知,对青蒿进行干燥破碎,可以增大青蒿与乙醚的接触面积,提高青蒿素的浸取率,用乙醚对青蒿素进行浸取后,过滤,可得滤液和滤渣,提取液经过蒸馏后可得青蒿素的粗品,对粗品加95%的乙醇,浓缩、结晶、过滤可得精品;
Ⅱ.由实验装置图可知,装置A为用过氧化氢制备氧气的装置,装置B中浓硫酸干燥反应生成的氧气,装置C中青蒿素在电炉中与氧气反应,装置中氧化铜的目的是保证碳元素完全转化为二氧化碳,减少实验误差,装置D中应盛放CaCl2吸收测定水的质量,装置E中盛放碱石灰吸收测定二氧化碳的质量,装置F的作用是防止外界空气中CO2,和H2O进入E装置,影响测定结果。
(1)根据乙醚浸取法的流程可知,对青蒿素进行干燥破碎,可以增大青蒿素与乙醚的接触面积,提高青蒿素的浸取率,故答案为:扩大接触面积,便于青蒿素被乙醚浸出;
(2)根据流程可知,操作a为过滤,操作b的名称是蒸馏,故答案为:过滤;蒸馏;
(3)操作a为过滤,需要的玻璃仪器主要有烧杯、漏斗、玻璃棒,故答案为:漏斗、烧杯;
(4)由题意可知青蒿素易受湿、热的影响而分解,所以操作a所用青蒿必须干燥且不宜加热,故答案为:青蒿素易受湿、热的影响而分解;
(5)测定青蒿素(烃的含氧衍生物)中氧元素的质量分数,应该知道样品的质量、反应生成二氧化碳和水的质量,则实验前至少称量样品、装置D(测定水的质量)和装置E(测定二氧化碳的质量)的质量,故答案为:3;
(6)因二氧化碳吸收需用到碱石灰固体,所以吸收水的试剂一定不能与二氧化碳反应,则装置D中应盛放CaCl2吸收测定水的质量,装置E中盛放碱石灰吸收测定二氧化碳的质量,装置F的作用是防止外界空气中CO2和H2O进入E装置,影响测定结果,故答案为:b;防止空气中的H2O和CO2被E吸收而影响实验结果;
(7)H2O2在二氧化锰催化作用下分解的化学方程式为2H2O2 ![]() 2H2O+O2↑,由方程式可知生成1mol O2消耗2mol H2O2,高锰酸钾与过氧化氢发生氧化还原反应的化学方程式为2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O,由方程式可知生成1mol O2消耗1mol H2O2,则产生等量O2,消耗H2O2的物质的量之比为2:1,故答案为:2:1;
2H2O+O2↑,由方程式可知生成1mol O2消耗2mol H2O2,高锰酸钾与过氧化氢发生氧化还原反应的化学方程式为2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O,由方程式可知生成1mol O2消耗1mol H2O2,则产生等量O2,消耗H2O2的物质的量之比为2:1,故答案为:2:1;
(8)由题意可知,燃烧m g青蒿素生成ag水、bg二氧化碳,由原子个数守恒可知,m g青蒿素中H的质量为![]() ×2×1g/mol,C的质量为
×2×1g/mol,C的质量为![]() ×12g/mol,则O的质量为m—
×12g/mol,则O的质量为m—![]() —
—![]() ,氧元素的质量分数为
,氧元素的质量分数为![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案