题目内容
【题目】利用如图所示装置进行下列实验,现象和结论均正确的是
选项 | ① | ② | ③中现象 | 结论 | 装置图 |
A | 浓硝酸 | Cu | 淀粉-KI溶液变蓝 | NO2为氧化性气体 |
|
B | 稀硫酸 | Na2SO3 | 品红溶液褪色 | Na2SO3未变质 | |
C | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
D | 浓氨水 | NaOH | 湿润红色石蕊试纸变蓝 | NH3为碱性气体 |
A. A B. B C. C D. D
【答案】D
【解析】A、NO2溶于水,发生3NO2+H2O=2HNO3+NO,可能是HNO3把KI中I-氧化成I2,故A错误;B、检验Na2SO3是否变质,应检验是否含有SO42-,故B错误;C、MnO2与浓盐酸反应,需要加热,但题中所给装置缺少加热装置,故C错误;D、利用NaOH固体遇水放出大量的热,是NH3·H2O分解成NH3,能使湿润的红色石蕊试纸变蓝,说明NH3为碱性气体,故D正确。

【题目】某学生用0.1000molL﹣1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要 .
(2)滴定: I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记录读数
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
Ⅳ,用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号) , 该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”).
②步骤Ⅳ中滴定时眼睛应:判断滴定终点的现象是 .
③若步骤II中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果(填“偏大”、“偏小”或“无影响”).
(3)按正确操作测得有关数据记录如下:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 20.38 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.38 | a |
①a的读数如图所示,则a=;
②烧碱样品的纯度为%.
【题目】金属钇(Y)具有重要的国防价值,但因过度开采已濒临枯竭。通过硫酸浸泡深海磷灰石矿,可以得到Y3+的浸出液:
表1 浸出液成分
Al3+ | Fe3+ | Ca2+ | PO43- | Mg2+ | Mn2+ | Y3+ | |
浓度/(mgL-1) | 7670 | 9460 | 550 | 640 | 5600 | 1500 | 70.2 |
(1)浸出液可用有机溶剂(HR)进行萃取,实现Y3+的富集(已知:Y3+与Fe3+性质相似),原理如下:Fe3+ + 3HR ![]() FeR3 + 3H+ Y3+ + 3HR
FeR3 + 3H+ Y3+ + 3HR ![]() YR3 + 3H+ (已知:FeR3、YR3均易溶于HR)
YR3 + 3H+ (已知:FeR3、YR3均易溶于HR)
浸出液在不同pH下萃取的结果如图1。
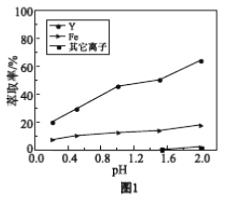
①用化学平衡原理解释,随pH增大,Y3+萃取率增大的原因________。
②结合图1解释,工业上萃取Y3+之前,应首先除去Fe3+的原因是________。
(2)采用“中和沉淀法”和“磷酸法”可以除铁。
表2 Fe3+、Y3+去除率
终点pH | 去除率/% | |
Fe3+ | Y3+ | |
3.0 | 87.84 | 19.86 |
3.5 | 92.33 | 23.63 |
4.5 | 99.99 | 44.52 |
5.0 | 99.99 | 89.04 |
中和沉淀法:向浸出液中加入NaOH除Fe3+,去除率如表2所示。
①该实验条件下,Fe3+去除率比Y3+大的可能原因________。
磷酸法:将磷酸(H3PO4:三元弱酸)加入到浸出液中,再加入Na2CO3溶液,调pH为2.5,过滤除去磷酸铁沉淀(FePO4),滤液中剩余的Fe3+、Y3+浓度如表3。
表3 滤液中Fe3+、Y3+的浓度
Fe3+ | Y3+ | |
浓度/(mgL-1) | 508 | 68.9 |
② 配平“磷酸法”除铁过程中的离子方程式
Fe3+ + + = FePO4↓+ CO2↑+ ,___________________
③ 综合分析表1、表2、表3,工业上采用“磷酸法”除铁的原因________。
(3)经“磷酸法”除铁后,用有机溶剂HR萃取Y3+,可通过________(填操作)收集含Y3+的有机溶液。
(4)综合分析以上材料,下列说法合理的是________。
a. 分析图1可知,pH在0.2~2.0范围内,有机溶剂中的Fe3+多于水溶液中的Fe3+
b. 表2中 Y3+损失率在20%左右的原因可能是生成的Fe(OH)3对Y3+的吸附
c. 表2中 pH在4.5~5.0范围内,Y3+损失率变大的可能原因:Y3+ + 3OH- = Y(OH)3↓
d. 有机溶剂萃取Y3+的优点是Ca2+、Mg2+、Mn2+等金属离子萃取率极低