��Ŀ����
����Ŀ���ҹ������������Ź�������ʱ�ھ���������������������� ˾ĸ�춦���Ⱦ�����ͭ������ͭ����Ҫ�ɷ���Cu����������������A���Sn��Pb���ش�����������
��1����̬Cuԭ�ӵļ۵����Ų�ͼ��___________________����̬Snԭ�ӵ�δ�ɶԵ�������Cu��__________����Pbλ�����ڱ���______________����
��2����CuSO4��Һ�м�������İ�ˮ�ټ������Ҵ�����������������ɫ������[Cu(NH3)4]SO4��H2O��
��SO42-��S���ӻ���ʽ��___________�����������ǽ����е縺����С��__________________��
�����ʾ��[Cu(NH3)4]2+�����е�ȫ����λ��____________��1mol[Cu(NH3)4]2+�к���_____mol������
��ˮ���ӵļ���Ϊ1050��С��NH3���Ӽ���1070�������˲����ԭ����_______________��
��3��ͭ����ģ����ͼ��ʾ�� ��Cu�������ⳤΪbpm����1��ͭ������Cuԭ�ӵ�������____g��1��ͭ������Cuԭ��ռ�ݵ����Ϊ______________pm3��
��Cu�������ⳤΪbpm����1��ͭ������Cuԭ�ӵ�������____g��1��ͭ������Cuԭ��ռ�ݵ����Ϊ______________pm3��
���𰸡� ![]() 2 p sp3 H
2 p sp3 H 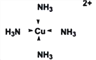 16 �µ��Ӷ�ռ�ݵĿռ�ϴ��ų�����ǿ�ڳɼ����Ӷ���ˮ�����д������Թµ��Ӷԣ���NH3�����д���1�Թµ��Ӷԣ���ˮ���Ӽ���С��NH3����
16 �µ��Ӷ�ռ�ݵĿռ�ϴ��ų�����ǿ�ڳɼ����Ӷ���ˮ�����д������Թµ��Ӷԣ���NH3�����д���1�Թµ��Ӷԣ���ˮ���Ӽ���С��NH3���� ![]() �� 4.25��10-22 ��
�� 4.25��10-22 ��
����������1����̬![]() ԭ����29��Ԫ�أ��۵����Ų�����
ԭ����29��Ԫ�أ��۵����Ų�����![]() ���ȫ���ĵ�����״̬���۵����Ų�Ϊ
���ȫ���ĵ�����״̬���۵����Ų�Ϊ![]() ����̬Snԭ�Ӻ�������Ų�1s2 2s2p6 3s23p63d10 4s24p64d10 5s25p2����̬Snԭ�ӵ�δ�ɶԵ�����Ϊ2��Cuԭ�ӵ�δ�ɶԵ�����Ϊ1�����߱�ֵΪ2��Pb���������Ų�Ϊ6s2 6p2������Pbλ�����ڱ���.P������ȷ����
����̬Snԭ�Ӻ�������Ų�1s2 2s2p6 3s23p63d10 4s24p64d10 5s25p2����̬Snԭ�ӵ�δ�ɶԵ�����Ϊ2��Cuԭ�ӵ�δ�ɶԵ�����Ϊ1�����߱�ֵΪ2��Pb���������Ų�Ϊ6s2 6p2������Pbλ�����ڱ���.P������ȷ����![]() ��2��P��
��2��P��
��2����![]() ��
��![]() ԭ�ӵ��ӻ���ʽΪ
ԭ�ӵ��ӻ���ʽΪ![]() ������ṹΪ����������
������ṹΪ����������![]() ���Ԫ��Ϊͭ�������⡢���������ķǽ�������ǿ��������������ǿ���縺����������Ԫ�أ���˵縺����С��Ϊ������ȷ�𰸣�sp3 ��H��
���Ԫ��Ϊͭ�������⡢���������ķǽ�������ǿ��������������ǿ���縺����������Ԫ�أ���˵縺����С��Ϊ������ȷ�𰸣�sp3 ��H��
��![]() �����еĻ�ѧ�������Ӽ������⼫�Լ���ͭ���ӺͰ�����λ��������[Cu(NH3)4]2+�����е�ȫ����λ��Ϊ
�����еĻ�ѧ�������Ӽ������⼫�Լ���ͭ���ӺͰ�����λ��������[Cu(NH3)4]2+�����е�ȫ����λ��Ϊ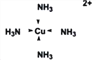 ��1mol[Cu(NH3)4]2+�к��е����3 mol����λ�� 1mol�����Ժ���4��4= 16mol��������ȷ�𰸣�
��1mol[Cu(NH3)4]2+�к��е����3 mol����λ�� 1mol�����Ժ���4��4= 16mol��������ȷ�𰸣� �� 16 ��
�� 16 ��
��ˮ���ӵļ���Ϊ1050��С��NH3���Ӽ���1070�������˲����ԭ���ǹµ��Ӷ�ռ�ݵĿռ�ϴ��ų�����ǿ�ڳɼ����Ӷԣ�ˮ�����д������Թµ��Ӷԣ���NH3�����д���1�Թµ��Ӷԣ���ˮ���Ӽ���С��NH3��������ȷ�����µ��Ӷ�ռ�ݵĿռ�ϴ��ų�����ǿ�ڳɼ����Ӷԣ�ˮ�����д������Թµ��Ӷԣ���NH3�����д���1�Թµ��Ӷԣ���ˮ���Ӽ���С��NH3���ӡ�
��3��ͭ����Ϊ������������������ͭԭ������Ϊ8��1/8+6��1/2=4,һ��������Cuԭ�ӵ�������4��64/NAg =![]() g��Cu�������ⳤΪbpm����Cuԭ�Ӱ뾶Ϊr=
g��Cu�������ⳤΪbpm����Cuԭ�Ӱ뾶Ϊr=![]() b/4pm, 1��ͭ������Cuԭ��ռ�ݵ����Ϊ4��4/3��r3=16/3��
b/4pm, 1��ͭ������Cuԭ��ռ�ݵ����Ϊ4��4/3��r3=16/3��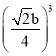 =��/12��
=��/12��![]() b)3 pm3����ȷ�𰸣�.
b)3 pm3����ȷ�𰸣�. ![]() �� 4.25��10-22 ����/12����
�� 4.25��10-22 ����/12����![]() b��3��
b��3��

����Ŀ��������(Y)������Ҫ�Ĺ�����ֵ��������ȿ����ѱ��ٿݽߡ�ͨ������������ʯ���Եõ�Y3+�Ľ���Һ��
��1 ����Һ�ɷ�
Al3+ | Fe3+ | Ca2+ | PO43- | Mg2+ | Mn2+ | Y3+ | |
Ũ��/(mgL-1) | 7670 | 9460 | 550 | 640 | 5600 | 1500 | 70.2 |
��1������Һ�����л��ܼ���HR��������ȡ��ʵ��Y3+�ĸ�������֪��Y3+��Fe3+�������ƣ���ԭ�����£�Fe3+ + 3HR ![]() FeR3 + 3H+ Y3+ + 3HR
FeR3 + 3H+ Y3+ + 3HR ![]() YR3 + 3H+ ����֪��FeR3��YR3��������HR��
YR3 + 3H+ ����֪��FeR3��YR3��������HR��
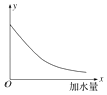
����Һ�ڲ�ͬpH����ȡ�Ľ����ͼ1��
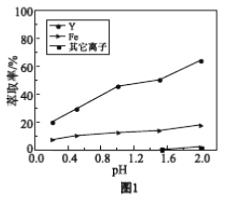
���û�ѧƽ��ԭ�����ͣ���pH����Y3+��ȡ�������ԭ��________��
�ڽ��ͼ1���ͣ���ҵ����ȡY3+֮ǰ��Ӧ���ȳ�ȥFe3+��ԭ����________��
��2���������кͳ��������������ᷨ�����Գ�����
��2 Fe3+��Y3+ȥ����
�յ�pH | ȥ����/% | |
Fe3+ | Y3+ | |
3.0 | 87.84 | 19.86 |
3.5 | 92.33 | 23.63 |
4.5 | 99.99 | 44.52 |
5.0 | 99.99 | 89.04 |
�кͳ������������Һ�м���NaOH��Fe3+��ȥ�������2��ʾ��
�ٸ�ʵ�������£�Fe3+ȥ���ʱ�Y3+��Ŀ���ԭ��________��
���ᷨ�������ᣨH3PO4����Ԫ���ᣩ���뵽����Һ�У��ټ���Na2CO3��Һ����pHΪ2.5�����˳�ȥ������������FePO4������Һ��ʣ���Fe3+��Y3+Ũ�����3��
��3 ��Һ��Fe3+��Y3+��Ũ��
Fe3+ | Y3+ | |
Ũ��/(mgL-1) | 508 | 68.9 |
�� ��ƽ�����ᷨ�����������е����ӷ���ʽ
Fe3+ + + = FePO4��+ CO2��+ ��___________________
�� �ۺϷ�����1����2����3����ҵ�ϲ��������ᷨ��������ԭ��________��
��3���������ᷨ�����������л��ܼ�HR��ȡY3+����ͨ��________����������ռ���Y3+���л���Һ��
��4���ۺϷ������ϲ��ϣ�����˵����������________��
a. ����ͼ1��֪��pH��0.2��2.0��Χ�ڣ��л��ܼ��е�Fe3+����ˮ��Һ�е�Fe3+
b. ��2�� Y3+��ʧ����20%���ҵ�ԭ����������ɵ�Fe(OH)3��Y3+������
c. ��2�� pH��4.5��5.0��Χ�ڣ�Y3+��ʧ�ʱ��Ŀ���ԭ��Y3+ + 3OH- = Y��OH��3��
d. �л��ܼ���ȡY3+���ŵ���Ca2+��Mg2+��Mn2+�Ƚ���������ȡ�ʼ���