题目内容
3.按要求回答下列问题.(1)某小组同学探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
①打开活塞a,逐滴加入H2SO3溶液到过量,烧瓶内溶液变为无色,该反应的离子方程式为H2SO3+Br2+H2O═4H++SO42-+2Br-,
得出的结论是:H2SO3的氧化性比Br2的氧化性弱(填“强”或“弱”).
②再打开活塞b,向所得溶液中逐滴加入H2O2,刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色,变橙黄色反应的离子方程式为2H++2Br-+H2O2=Br2+2H2O,得出的结论是H2O2的氧化性比Br2的氧化性强(填“强”或“弱”).
(2)某学习小组向盛有氯化钡溶液的试管中通入二氧化硫气体,发现有白色沉淀,为了清楚沉淀的物质,研究小组向试管中加入过量稀盐酸,沉淀不溶解,你认为沉淀物是BaSO4,产生该物质可能的原因是空气中的O2将SO32-氧化为SO42-.
(3)为探究SO2使品红溶液褪色的原因,该小组同学将干燥的SO2气体通入品红的四氯化碳溶液中,发现品红不褪色,由此所得出的结论正确的是ac(填编号)
a.SO2使品红溶液褪色的微粒一定不是SO2分子
b.SO2使品红溶液褪色的微粒一定是H2SO3分子
c.此实验无法确定SO2使品红溶液褪色的微粒
d.将干燥的SO2气体通入品红的酒精溶液中,能使品红褪色
由此可猜想使品红溶液褪色的微粒可能是H2SO3或HSO3-或SO32-.
(4)配平并完成下列离子方程式
2 MnO4-+5 H2O2+6H+=2 Mn2++5 O2+8 H2O
每有1mol高锰酸根参加反应,生成2.5mol O2.
分析 (1)①打开活塞a,逐滴加入H2SO3溶液到过量,烧瓶内溶液变为无色,说明溴与亚硫酸发生氧化还原反应生成硫酸和溴化氢,证明溴的氧化性大于亚硫酸;
②再打开活塞b,向所得溶液中逐滴加入H2O2,溶液变为橙黄色,说明溴离子被双氧水氧化成溴单质,据此写出离子方程式;证明了双氧水的氧化成大于溴单质;
(2)白色沉淀不溶于稀盐酸,该沉淀只能为硫酸钡;可能原因为亚硫酸被氧化成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀;
(3)根据品红溶液与品红的四氯化碳溶液的区别及二氧化硫的性质进行判断;
(4)根据氧化还原反应中得失电子数相等及质量守恒配平方程式;根据配平后的方程式计算出每有1mol高锰酸根参加反应生成氧气的物质的量.
解答 解:(1)①打开活塞a,逐滴加入H2SO3溶液到过量,烧瓶内溶液变为无色,说明溴与亚硫酸发生反应生成硫酸和溴化氢,反应的离子方程式为:H2SO3+Br2+H2O═4H++SO42-+2Br-,证明了亚硫酸的氧化性比溴弱,
故答案为:H2SO3+Br2+H2O═4H++SO42-+2Br-;弱;
②再打开活塞b,向所得溶液中逐滴加入H2O2,刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色,溴离子被氧化成溴单质,变橙黄色反应的离子方程式为:2H++2Br-+H2O2=Br2+2H2O,证明H2O2的氧化性比Br2的氧化性强,
故答案为:2H++2Br-+H2O2=Br2+2H2O;强;
(2)某学习小组向盛有氯化钡溶液的试管中通入二氧化硫气体,发现有白色沉淀,向试管中加入过量稀盐酸,沉淀不溶解,该白色沉淀为BaSO4,产生沉淀的原因可能为:空气中的O2将SO32-氧化为SO42-,硫酸根离子与钡离子反应生成硫酸钡沉淀,
故答案为:BaSO4;空气中的O2将SO32-氧化为SO42-;
(3)二氧化硫与四氯化碳不反应,能够与水反应生成亚硫酸,亚硫酸能够电离出硫酸氢根离子、亚硫酸根离子,将干燥的SO2气体通入品红的四氯化碳溶液中,发现品红不褪色,而将二氧化硫通入品红溶液会褪色,证明使品红溶液褪色的不是二氧化硫分子,可能为H2SO3或HSO3-或SO32-,该实验不能证明使品红溶液褪色的粒子,故ac正确,
故答案为:ac;H2SO3或HSO3-或SO32-;
(4)反应中物质的化合价变化:MnO4-→Mn2+,Mn元素化合价由+7价→+2价,一个MnO4-得5个电子;H2O2→O2,
O由-1价变成0价,一个H2O2分子失去2个电子,所以其最小公倍数为10,故MnO4-的计量数为2,双氧水的计量数为5,然后根据原子守恒配平其它元素,配平后的离子方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O;
根据反应可知,1mol高锰酸根离子完全反应生成氧气的物质的量为:1mol×$\frac{5}{2}$=2.5mol,
故答案为:2;5;6H+;2;5;8;2.5.
点评 本题考查了性质实验方案的设计,题目难度中等,涉及氧化性、还原性强弱比较、氧化还原反应的配平及计算、性质方案的设计与评价等知识,试题知识点较多、综合性较强,充分考查学生的分析能力、化学实验能力及灵活应用基础知识的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①向饱和Na2CO3溶液中通入过量的CO2
②向Na2SiO3溶液中逐滴加入过量稀硫酸
③向Ba(NO3)2溶液中通入过量的SO2
④向石灰水中通入过量的CO2气体
⑤向AlCl3溶液中逐滴滴加NaOH溶液至过量.
| A. | ①②③④ | B. | ①②⑤ | C. | ①②③⑤ | D. | ①②③ |
①HClO(aq)+OH-(aq)=ClO-(aq)+H2O(l)△H=-Q1kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | 在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq)△H=-(57.3+Q1)kJ•mol-1 | |
| B. | 将20mL 1mol/L HClO与10mL 1mol/L NaOH混合后的溶液,一定存在:2C(H+)-2C(OH-)=C(ClO-)-C(HClO) | |
| C. | 已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=HSO3-+ClO- | |
| D. | 已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中:C(Na+)>C(ClO-)>C(CH3COO-)>C(OH-)>C(H+) |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
| A. | 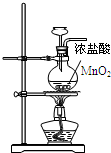 制取Cl2用 制取Cl2用 | |
| B. | 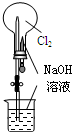 可完成“喷泉”实验 可完成“喷泉”实验 | |
| C. | 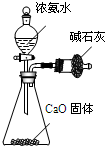 制取干燥的NH3 制取干燥的NH3 | |
| D. | 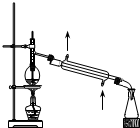 分离石油,得到汽油、煤油和柴油等各种馏分 分离石油,得到汽油、煤油和柴油等各种馏分 |
 ;
;