题目内容
2.已知氯元素的相对原子质量为35.5,由2311Na、3517Cl和3717Cl构成的10g氯化钠中,已知3517Cl和的3717Cl组成与天然存在的组成相同,求其中所含3517Cl和3717Cl两种原子的质量分别是多少g?分析 元素的相对原子质量为该元素各种核素的相对原子质量的平均值,原子的相对原子质量在数值上等于其质量数,先根据元素的相对原子质量计算3517Cl和3717Cl的原子个数比,再根据原子个数比计算3517Cl和3717Cl的质量.
解答 解:10g氯化钠中氯元素的质量=10g×$\frac{35.5}{35.5+23}$=6.1g;氯元素的相对原子质量35.5是质量数分别为35和37的核素根据各自的丰度算出来的平均值,可以采用十字交叉法计算其原子个数比;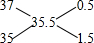 ,3717Cl和3517Cl的原子个数之比为0.5:1.5=1:3,所以含3717Cl的质量=$\frac{6.1g}{35.5g/mol}$×$\frac{1}{1+3}$×100%×35g/mol=1.5g,则含3517Cl的质量为6.1g-1.5g=4.6g.
,3717Cl和3517Cl的原子个数之比为0.5:1.5=1:3,所以含3717Cl的质量=$\frac{6.1g}{35.5g/mol}$×$\frac{1}{1+3}$×100%×35g/mol=1.5g,则含3517Cl的质量为6.1g-1.5g=4.6g.
答:10g氯化钠中3717Cl的质量为1.5g,3517Cl的质量为4.6g.
点评 本题以计算核素的质量为载体考查了同位素原子个数的计算,难度不大,明确元素的相对原子质量为该元素各种核素的相对原子质量的平均值是解本题的关键.

练习册系列答案
相关题目
12.有A、B、C三种有机物,结构简式如下所示,试回答有关问题:
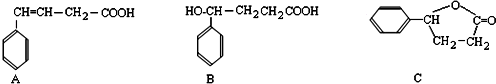
(1)A与C的关系为同分异构体.
(2)A→B的反应类型为加成反应.
(3)B→C的化学方程式为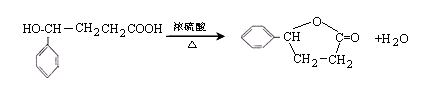 .
.
(4)A经加聚反应所得聚合物的结构简式为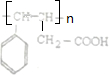 .
.

(1)A与C的关系为同分异构体.
(2)A→B的反应类型为加成反应.
(3)B→C的化学方程式为
 .
.(4)A经加聚反应所得聚合物的结构简式为
 .
.
13.下列关于某些离子的检验及结论,一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变浑浊,则一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- | |
| C. | 加入稀硝酸无明显现象,再加入硝酸银有白色沉淀产生,则一定有Cl- | |
| D. | 加入Na2CO3 溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ba2+ |
8.次氯酸可用于杀菌消毒.已知25°C时:
①HClO(aq)+OH-(aq)=ClO-(aq)+H2O(l)△H=-Q1kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
①HClO(aq)+OH-(aq)=ClO-(aq)+H2O(l)△H=-Q1kJ•mol-1
②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | 在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq)△H=-(57.3+Q1)kJ•mol-1 | |
| B. | 将20mL 1mol/L HClO与10mL 1mol/L NaOH混合后的溶液,一定存在:2C(H+)-2C(OH-)=C(ClO-)-C(HClO) | |
| C. | 已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=HSO3-+ClO- | |
| D. | 已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中:C(Na+)>C(ClO-)>C(CH3COO-)>C(OH-)>C(H+) |
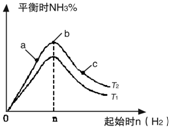 某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):