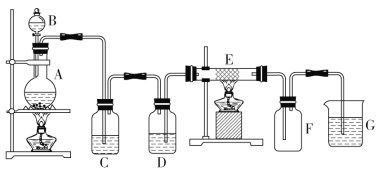
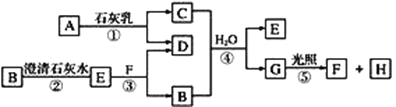
题目内容
【题目】实验室常用碱性溶液吸收多余的氯气,防止污染环境。若某一次兴趣小组实验中将多余的氯气用100 mL 2.00 mol·L-1的NaOH溶液恰好完全吸收。分析吸收液测得ClO-和![]() 的物质的量浓度之比为5∶1。请回答:
的物质的量浓度之比为5∶1。请回答:
(1)吸收的氯气的物质的量为____mol。
(2)若不考虑吸收前后溶液体积变化,则吸收液中Cl-的物质的量浓度为________。
【答案】0.100 1.25 mol·L-1
【解析】
(1)根据题意,NaOH溶液吸收Cl2时发生反应:Cl2+2NaOH![]() NaCl+NaClO+H2O和3Cl2+6NaOH
NaCl+NaClO+H2O和3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,从化学方程式来看,参加反应的氯气的量始终是参加反应的NaOH的量的一半;
5NaCl+NaClO3+3H2O,从化学方程式来看,参加反应的氯气的量始终是参加反应的NaOH的量的一半;
(2) 若吸收液中ClO-和ClO3-的物质的量浓度之比5∶1,从得失电子守恒的观点来看,则三种微粒的物质的量浓度之比c(Cl-)∶c(ClO-)∶c(![]() )=10∶5∶1,根据Na、氯原子守恒求算。
)=10∶5∶1,根据Na、氯原子守恒求算。
(1)根据题意,NaOH溶液吸收Cl2时发生反应:Cl2+2NaOH![]() NaCl+NaClO+H2O和3Cl2+6NaOH
NaCl+NaClO+H2O和3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,从化学方程式来看,参加反应的氯气的量始终是参加反应的NaOH的量的一半,所以吸收的氯气的物质的量为2mol/L×0.1L÷2=0.100 mol;
5NaCl+NaClO3+3H2O,从化学方程式来看,参加反应的氯气的量始终是参加反应的NaOH的量的一半,所以吸收的氯气的物质的量为2mol/L×0.1L÷2=0.100 mol;
(2) 若吸收液中ClO-和ClO3-的物质的量浓度之比5∶1,从得失电子守恒的观点来看,则三种微粒的物质的量浓度之比c(Cl-)∶c(ClO-)∶c(![]() )=10∶5∶1,根据Na、氯原子守恒,c(Cl-)+c(ClO-)+c(
)=10∶5∶1,根据Na、氯原子守恒,c(Cl-)+c(ClO-)+c(![]() )= 2mol/L,可知c(Cl-)=1.25 mol·L-1。
)= 2mol/L,可知c(Cl-)=1.25 mol·L-1。

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目