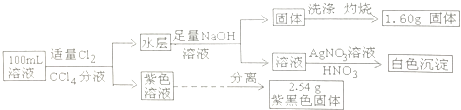
题目内容
【题目】下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
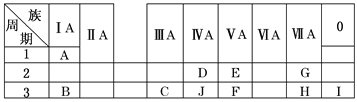
(1)表中元素,化学性质最不活泼的是________,只有负价而无正价的元素是________。
(2)C元素在元素周期表中的位置是第三周期第________族。
(3)最高价氧化物的水化物酸性最强的是________,呈两性的是________。
(4)A分别与E、G、H形成的化合物中,最稳定的是________。
(5)在B、C、E、F中,原子半径最大的是________。
(6)B、H两种元素所形成的化合物所含的化学键类型为________________。
(7)写出C的最高价氧化物与H的氢化物之间反应的离子方程式:__________________________。
(8)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式:________________________________________________________________________。
【答案】 Ar F ⅢA HClO4 Al(OH)3 HF Na 离子键 Al2O3+6H+===2Al3++3H2O Al(OH)3+NaOH===NaAlO2+2H2O
【解析】根据元素周期表的结构,表中A、B、C、D、E、F、G、H、I、J元素分别是H、Na、Al、C、N、P、F、Cl、Ne、Si,(1)化学性质最不活泼的应是惰性气体,即Ne;只有负价而无正价的元素是F;(2)C是Al元素,在元素周期表中的位置是第三周期第ⅢA族;(3)最高价氧化物的水化物酸性最强的是HClO4,呈两性的是Al(OH)3;(4)同周期元素从左到右非金属性逐渐增强,同主族元素从上而下非金属性逐渐减弱,非金属性越强气态氢化物的稳定性越强,则A分别与E、G、H形成的化合物NH3、HF、HCl中,最稳定的是HF;(5) 同周期元素从左到右原子半径依次减小,同主族元素从上而下原子半径依次增大,在B、C、E、F中,原子半径最大的是Na;(6)B、H两种元素所形成的化合物NaCl为钠离子和氯离子构成的离子化合物,所含的化学键类型为离子键;(7) C的最高价氧化物氧化铝与H的氢化物HCl之间反应的离子方程式为:Al2O3+6H+=2Al3++3H2O; (8) B与C两种元素的最高价氧化物对应的水化物Al(OH)3和NaOH相互反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:___________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) ![]() CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g) ![]() CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。达到平衡时甲醇的转化率α(CH3OH)= _________
【题目】(1)已知甲、乙两物质分别由H、C、Na、O、Cl、Fe元素中的一种或几种组成,请按要求填空:
①若甲物质为碱性氧化物,则甲的化学式为___________________(写一种)。
②若乙物质可用于呼吸面具中作为氧气来源,则乙是___________,其供氧原理是__________(用化学方程式表示)。
(2)在横线上填入合适的符号:________+2H+=CO2↑+H2O+Ba2+
(3)写出氯气与水反应的化学方程式,并用双线桥法标出电于转移的方向和数目:______________________________________________________。
(4)选择合适的试剂除去下列括号内的杂质。(填化学式)
物质 | 选择的试剂 |
①FeCl2(FeCl3) | ______ |
②NO气体(NO2) | _____________ |