题目内容
【题目】常温下,有pH=1的某溶液中可能含有Na+、Fe2+、Fe3+、I﹣、Cl﹣、CO32﹣中的某几种,现取100mL该溶液进行如下实验: 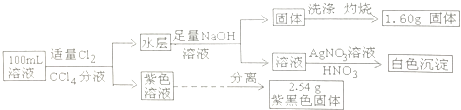
根据实验结果,下列判断正确的是( )
A.Fe2+、I﹣、Cl﹣三种离子一定存在
B.不能确定Na+和Cl﹣是否存在,CO ![]() 一定不存在
一定不存在
C.Fe3+与Fe2+至少有一种
D.该溶液中c(Cl﹣)≥0.1mol?L﹣1
【答案】AD
【解析】解:pH=1的溶液中氢离子浓度为0.1mol/L,100mL该溶液中含有氢离子的物质的量为0.01mol,则一定不存在CO ![]() ; 向溶液中通入氯气分液后得到紫色溶液,则原溶液中含有I﹣ , 铁离子能够氧化碘离子,则一定不存在Fe3+;2.54g为碘单质,物质的量为
; 向溶液中通入氯气分液后得到紫色溶液,则原溶液中含有I﹣ , 铁离子能够氧化碘离子,则一定不存在Fe3+;2.54g为碘单质,物质的量为 ![]() =0.01mol,原溶液中含有碘离子的物质的量为0.02mol;
=0.01mol,原溶液中含有碘离子的物质的量为0.02mol;
水层中加入氢氧化钠溶液得到固体,该固体为氢氧化亚铁,灼烧固体得到的1.60g为氧化铁,则溶液中一定存在Fe2+ , 根据铁元素守恒可知亚铁离子的物质的量为: ![]() ×2=0.02mol,0.02mol亚铁离子带有正电荷为0.04mol,0.02mol碘离子带有0.02mol电子,所以原溶液中一定含有Cl﹣ , 其物质的量至少为0.04mol﹣0.02mol﹣0.01mol=0.01mol,氯离子的浓度最小为
×2=0.02mol,0.02mol亚铁离子带有正电荷为0.04mol,0.02mol碘离子带有0.02mol电子,所以原溶液中一定含有Cl﹣ , 其物质的量至少为0.04mol﹣0.02mol﹣0.01mol=0.01mol,氯离子的浓度最小为 ![]() =0.1mol/L,
=0.1mol/L,
A.根据分析可知,原溶液中一定含有Fe2+、I﹣、Cl﹣ , 故A正确;
B.原溶液中一定不存在CO ![]() ,一定含有Cl﹣ , 故B错误;
,一定含有Cl﹣ , 故B错误;
C.原溶液中一定存在Fe2+ , 一定不存在Fe3+ , 故C错误;
D.根据分析可知该溶液中c(Cl﹣)≥0.1nolL﹣1 , 故D正确;
故选AD.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目