��Ŀ����
���Ǵ����к����������壬�о������仯�������������Ҫ�����塣
��1���ϳɰ���ԭ��Ϊ��N2(g)+3H2(g) 2NH3 (g) ��H=" -" 92.4kJ/mol
2NH3 (g) ��H=" -" 92.4kJ/mol
�ٽ�һ������N2(g)��H2(g)����1L���ܱ������У���500�桢2��107Pa�´ﵽƽ�⣬ƽ��ʱ���N2Ϊ0.1 mol��H2Ϊ0.3 mol��NH3Ϊ0.1 mol����������H2��ת����Ϊ ��
���¶��¸÷�Ӧ��ƽ�ⳣ��K�� ��
�������H2��ת���ʣ����д�ʩ���е��� ��
a���������а�ԭ�����ٳ���ԭ����
b�����������ٳ����������
c���ı䷴Ӧ�Ĵ���
d��Һ��������������
��2����2L�ܱ������У�800��ʱ��Ӧ2NO(g)��O2(g) 2NO2(g)��H��0��ϵ�У����ɷ�Ũ����ʱ��ı仯��ͼ��
2NO2(g)��H��0��ϵ�У����ɷ�Ũ����ʱ��ı仯��ͼ��
����O2��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v��___________��
����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬���� _________��
a��v(NO2)=2v(O2)
b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2)
d�������ڵ��ܶȱ��ֲ���
��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����_________��
a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч�Ĵ���
��3������β���к���CO��NO2���ж����壬��������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����塣
4CO(g)��2NO2(g) 4CO2(g)��N2(g) ��H����1 200 kJ��mol��1
4CO2(g)��N2(g) ��H����1 200 kJ��mol��1
���ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����______(�����)��
��1���� 33.3% ��2�֣� K=3.7��L/mol��2��100/27��L/mol��2��2�֣�
��ad��2�֣�
��2���� 1.5��10��3mol/(L��s)��2�֣� ��b c ��2�֣� ��c��1�֣�
��3���� ��1�֣�
���������������1������������ʽ���м��㣺N2(g) + 3H2(g) 2NH3(g)
2NH3(g)
��ʼŨ�ȣ�mol?L?1�� 0.15 0.45 0
��ʼŨ�ȣ�mol?L?1�� 0.05 0.15 0.1
��ʼŨ�ȣ�mol?L?1�� 0.1 0.3 0.1
��H2��ת����=0.15mol/L��0.45mol/L��100%=33.3%�����¶��¸÷�Ӧ��ƽ�ⳣ��K��(0.1mol?L?1)2��[0.1mol/L��(0.3mol?L?1)3]= 3.7��L/mol��2��
��a���������а�ԭ�����ٳ���ԭ������ѹǿ����ƽ�������ƶ���H2��ת����������ȷ��b�����������ٳ���������壬ƽ�ⲻ�ƶ���H2��ת���ʲ��䣬����c���ı䷴Ӧ�Ĵ�����ƽ�ⲻ�ƶ���H2��ת���ʲ��䣬����d��Һ����������������ƽ�������ƶ���H2��ת����������ȷ��
��2���ٸ���ͼ���и�����Ũ�ȸı䣬��֪aΪNO2��bΪNO��cΪO2�ģ���0��2s�ڸ÷�Ӧ��ƽ������v(O2)=(0.005mol?L?1-0.002mol?L?1)��2s=1.5��10��3mol/(L��s)
��a��v(NO2)=2v(O2)��û��ע������Ӧ�����淴Ӧ������b������������䣬����ѹǿ���ֲ����˵����Ӧ�ﵽƽ�⣬��ȷ��c��v��(NO)��2v��(O2)��˵������Ӧ���ʵ����淴Ӧ���ʣ���Ӧ�Ѵﵽƽ�⣬��ȷ��d������������������Ϊ��ֵ�����������ڵ��ܶȱ��ֲ��䲻��˵����Ӧ�ﵽƽ�⣬����
��a����ʱ�����NO2���壬��Ӧ���ʼ�С������b����Ϊ����ӦΪ���ȷ�Ӧ�������ʵ������¶�ƽ�����淴Ӧ�����ƶ�������c. ����O2��Ũ��, ��Ӧ����������ƽ��������Ӧ�����ƶ�����ȷ��d��ѡ���Ч�Ĵ�����ƽ�ⲻ�ƶ�������
��3���¶�������T2������Ӧ���ʺ��淴Ӧ���ʶ�����v����v�����������������Լ�ͼ����T2�¶ȸߣ���Ӧ���ʴ�ƽ�����淴Ӧ�����ƶ���NO2��ת���ʼ�С����ͼ����ȷ��ѹǿ����ƽ��������Ӧ�����ƶ���CO�����������С����ͼ������
���㣺���⿼�黯ѧƽ����жϡ���ѧƽ���ƶ�����Ӧ�����뼰��ѧƽ��ļ��㡢ͼ��ķ�����

��ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�á�
��1�����á���ѧ����ת�Ʒ����ᴿ�����ٵķ�Ӧԭ��ΪW(s)��I2(g) WI2(g) (I)���÷�Ӧ��ʯӢ��չ��н��У�����ͼ��ʾ��
WI2(g) (I)���÷�Ӧ��ʯӢ��չ��н��У�����ͼ��ʾ��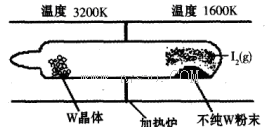
�ٷ�Ӧ(I)��ƽ�ⳣ������ʽK��_______����K��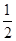 ����ij�����ܱ������м���1mol I2(g)������W(s)����Ӧ�ﵽƽ��ʱI2(g)��ת����Ϊ__________��
����ij�����ܱ������м���1mol I2(g)������W(s)����Ӧ�ﵽƽ��ʱI2(g)��ת����Ϊ__________��
�ڷ�Ӧ(I)�ġ�H____0���������������������Ӧ��ϵ�п�ѭ��ʹ�õ�������_________��
���ܹ�˵��������Ӧ�Ѿ��ﵽƽ��״̬����_________������ţ���
a��I2��WI2��Ũ�����
b��W���������ٱ仯
c�������ڻ��������ܶȱ��ֲ���
d����λʱ���ڣ����������ĵ����ʵ�����⻯�����ɵ����ʵ������
��2��25��ʱ��NaHSO3��ˮ��ƽ�ⳣ����1.0��10��12mol/L������¶���H2SO3 HSO3����H���ĵ��볣��Ka��____mol/L������H2SO3��Һ�м���������I2������Һ��
HSO3����H���ĵ��볣��Ka��____mol/L������H2SO3��Һ�м���������I2������Һ��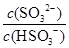 ��________�����������С�����䡱����
��________�����������С�����䡱����
��3��ֱ���ŷź�SO2���������γ����꣬Σ����������Na2SO3��Һ����SO2�Ĺ����У�pH��n��SO32������n(HSO3��)�仯��ϵ���±���
| n(SO32��): n ( HSO3��) | 91:9 | 1:1 | 1:91 |
| pH(25��) | 8.2 | 7.2 | 6.2 |
������Һ������ʱ����Һ������Ũ���ɴ�С��˳��Ϊ_________________________��
25 ��ʱ�������Ϊ2 L���ܱ������У���̬A��B��C�����ʵ���n��ʱ��t�ı仯��ͼ1��ʾ����֪�ﵽƽ������¶ȣ�A��ת���ʽ�����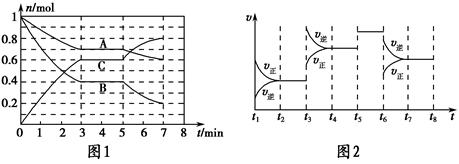
| t2��t3 | t4��t5 | t5��t6 | t7��t8 |
| K1 | K2 | K3 | K4 |
(1)����ͼ1���ݣ�д���÷�Ӧ�Ļ�ѧ����ʽ��__________________���˷�Ӧ��ƽ�ⳣ������ʽK��___���ӷ�Ӧ��ʼ����һ��ƽ��ʱ��ƽ������v(A)Ϊ___��
(2)��5��7 min�ڣ���Kֵ���䣬��˴����߱仯��ԭ����__________��
(3)��ͼ2��ʾ�˷�Ӧ�ķ�Ӧ����v��ʱ��t�Ĺ�ϵͼ�����ε�ƽ�ⳣ�������ʾ��K1��K2��K3��K4֮��Ĺ�ϵΪ________(�á�>������<����������)��A��ת��������һ��ʱ����________��
�����̵��ͺϳɵ����ܵ�����Ҫ��ʽ���±��Ǵ����̵��ͺϳɰ��IJ���Kֵ��
| | N2+O2 2NO 2NO | N2+3H2 2NH3 2NH3 | ||
| �¶� | 25�� | 2000�� | 25�� | 400�� |
| ƽ�ⳣ��K | 3.84��10-31 | 0.1 | 5��108 | 200 |
��1�������̵���_______(�����ȡ��������ȡ�)��Ӧ���˹��̵���ũҵ����ʮ���ش��ݱ������ݣ�����֪�ϳɰ�����Ҫ���о�������______________________________________��
��2����ҵ�ϳɰ�ԭ�������Ʊ���Ҫ�������£�
���Կ���Ϊԭ���Ʊ�N2���䷽����______________________________________��
���Խ�̿��ˮΪԭ���Ʊ�H2����Ӧԭ��Ϊ____________________��__________________��
H2�л��е�CO���ô�����ͭ����Һ���գ��Է�ֹ�ϳɰ�ʱ�����ж���
CO(g)+Cu(NH3)2Ac(aq)
 Cu(NH3)2AC��CO(aq)+Q(Q>0)
Cu(NH3)2AC��CO(aq)+Q(Q>0)Ҫ�ӳ��Ӻ����Һ�С���������������ͭ������________(������������)�¡�____(������������)ѹ��
��3��Һ����ˮ���ƣ�Ҳ�������(����)��NH3+NH3
 NH4++NH2-��
NH4++NH2-����Һ�������ӻ����Ա�ʾΪ________________��
��25��ʱ��Һ�������ӻ�K=1.0��10-30������NaNH2�������Һ���У���������Һ�в����ڵĹ�ϵʽ��(���¶ȱ��ֲ���)_________ (ѡ����)
a��c(Na+)=c(NH2-) b��c(NH4+)��c(NH2-)=1.0��10-30 c��c(NH2-)> c(NH4+)
��4������Һ����NaNH2��NH4Cl������ȫ���룬���ñ�NaNH2Һ����Һ�ζ�δ֪Ũ��NH4ClҺ����Һʱ����Ӧ�����ӷ���ʽΪ_______________________��
��һ��������ܱ������У����л�ѧ��ӦCO2 (g)+H2 (g) CO (g)+H2O (g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO (g)+H2O (g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t / �� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=____________��
��2������ӦΪ________��Ӧ������ȡ����ȡ�����
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������________����ѡ�۷֣���
A��������ѹǿ���� B�����������c (CO)����
C��v��(H2)=v��(H2O) D��c (CO2)="c" (CO)
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c (CO2)��c (H2)="c" (CO)��c (H2O)�����жϴ�ʱ���¶�Ϊ________�档
I���跴Ӧ��Fe(s)+CO2(g)  FeO(s)+CO(g)��ƽ�ⳣ��ΪK1��
FeO(s)+CO(g)��ƽ�ⳣ��ΪK1��
��Ӧ��Fe(s)+H2O(g)  FeO(s)+H2(g)��ƽ�ⳣ��ΪK2��
FeO(s)+H2(g)��ƽ�ⳣ��ΪK2��
�ڲ�ͬ�¶��£�K1��K2��ֵ���£�
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g)������һ�� (������š�)�ȷ�Ӧ��Ҫʹƽ��������ƶ����ɲ�ȡ�Ĵ�ʩ�� (�����)��
CO(g)+H2O(g)������һ�� (������š�)�ȷ�Ӧ��Ҫʹƽ��������ƶ����ɲ�ȡ�Ĵ�ʩ�� (�����)��A����С��Ӧ�����ݻ�
B������Ӧ�����ݻ�
C�������¶�
D�������¶�
E��ʹ�ú��ʵĴ���
F���跨����CO����
(2)����ӦFe(s)+CO2(g)
 FeO(s)+CO(g)���¶�T1�½��У�Fe(s)+H2O(g)
FeO(s)+CO(g)���¶�T1�½��У�Fe(s)+H2O(g)  FeO(s)+H2(g)���¶�T2�½��У���֪T1>T2����c(CO2)>c(H2O)(������������ͬ)�������ߵķ�Ӧ���� (�����)
FeO(s)+H2(g)���¶�T2�½��У���֪T1>T2����c(CO2)>c(H2O)(������������ͬ)�������ߵķ�Ӧ���� (�����)A��ǰ�ߴ� B�����ߴ� C��һ���� D�����ж�
II��(1)ˮ�ĵ���ƽ��������ͼ��ʾ����A���ʾ25��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȣ�B���ʾ100��ʱˮ�ĵ����ƽ��ʱ������Ũ�ȡ���100��ʱ1 mol��L��1��NaOH��Һ�У���ˮ�������c(H��)��________mol��L��1��KW(25��)________KW(100��)(�>������<������)��25 ��ʱ����ˮ�ĵ���ƽ����ϵ�м�������NH4HCO3���壬��ˮ�ĵ���ƽ���Ӱ����________(��ٽ����������ơ���Ӱ�족)��

(2)����ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ����������֪������ݡ�
| ��ѧʽ | ����ƽ�ⳣ��(25��) |
| HCN | K��4.9��10��10 |
| CH3COOH | K��1.8��10��5 |
| H2CO3 | K1��4.3��10��7��K2��5.6��10��11 |
��25��ʱ���е�Ũ�ȵ�NaCN��Һ��Na2CO3��Һ��CH3COONa��Һ��������Һ��pH�ɴ�С��˳��Ϊ ____��
��25 ��ʱ����ͬŨ�ȡ���ͬ�����CH3COOH��Һ��NaOH��Һ��ϣ� ������Һ��c(Na��)________c(CH3COO��)(�>������<������)
����NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽΪ_______________________________��


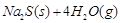 ����ش��������⣺
����ش��������⣺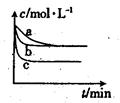
 2NH3 ��H=" -" 92.4kJ/mol
2NH3 ��H=" -" 92.4kJ/mol 2NO2(g) ��H��0��ϵ�У����ɷ�Ũ����ʱ��ı仯��ͼ��
2NO2(g) ��H��0��ϵ�У����ɷ�Ũ����ʱ��ı仯��ͼ��
 4CO2(g)��N2(g) ��H����1 200 kJ��mol��1���ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����______(�����)��
4CO2(g)��N2(g) ��H����1 200 kJ��mol��1���ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����______(�����)��
