题目内容
【题目】A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定。

试确定A、B、C、D、X各代表何种溶液。
A:________,B:__________,C:_________,D:_________,X:_________。
【答案】 NaOH NaNO3 Ba(NO3)2 HNO3 MgSO4
【解析】因为NaNO3、HNO3不能与其他物质反应生成沉淀,故X与NaOH和Ba(NO3)2反应生成白色沉淀,实质就是X中的金属离子和氢氧根能结合成白色沉淀,X中的酸根离子和钡离子结合成沉淀,故X应该是MgSO4,生成的白色沉淀是氢氧化镁和硫酸钡,氢氧化镁溶于硝酸,硫酸钡不溶于硝酸,由此可推断则A是NaOH,B是NaNO3,C是Ba(NO3)2,D是HNO3,X是MgSO4,故答案为:NaOH;NaNO3;Ba(NO3)2;HNO3;MgSO4。

【题目】汽车尾气中含有上百种化合物,污染物中以NO为主。请回答下列与NO相关的问题:
(1)汽车发动机工作时燃料燃烧会使氮气转化为NO。
已知:N2(g)+O2(g)=2NO(g) △H=+akJ·mol-1。NO中氮氧键键能为b kJ·mol-1、O=O键能为 c kJ·mol-1。
计算N_N的键能为____________kJ·mol-1(用含a、b、c的代数式表示)。
(2)NO和CO在一定温度和催化剂的条件下可发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-538 kJ·mol-1。
N2(g)+2CO2(g) △H=-538 kJ·mol-1。
一定温度下,向体积为2L的密闭容器中充入一定量的NO和CO,发生上述反应。反应过程中测定的部分数据见下表:
时间/min | n(NO)/mol | n(CO)/mol | n(N2)/mol | n(CO2)/mol |
0 | 0.100 | 0.200 | 0 | 0 |
4 | 0.020 | |||
6 | 0.050 | |||
8 | 0.025 |
①反应在0~4 min内的平均速率v(CO)=_____________。
②下列叙述中,能说明反应已达到平衡的是____________。
a.NO的消耗速率和CO2的生成速率相等 b.容器内的压强不再变化
c.混合气体的密度不再变化 d.N2的百分含量不再变化
③计算该温度下的平衝常数K=____________。
④8min时,其他条件不变,向该反应容器中再通入0.05molNO和0.100CO,重新达到平衡时混合气体中N2的百分含量将____________(填“减小”、“增大”或“不变” )。
(3)工业上采用电解NO的方法制备NH4NO3,其工作原理如图。X、Y皆为Pt电极,为使电解产物全部转化为NH4NO3,需补充NH3。
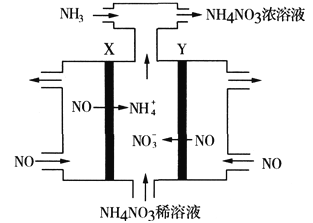
①Y电极上的电极反应式为_______________________________。
②若X电极上有11.2L(已换算成标准状况)NO发生反应,则生成NH4NO3的质量为____________g。