题目内容
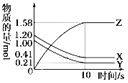
【题目】某固体混合物,由NaOH、AlCl3、MgCl2组成,将它放入足量的水中,充分搅拌后,有0.58g白色沉淀,在所得到的浊液中逐滴加入0.5mol/L的盐酸,加入盐酸的体积与生成沉淀的质量(g)关系如图所示。(假定:加入NaOH溶液后,Al3+、Mg2+转化为沉淀不存在先后顺序)
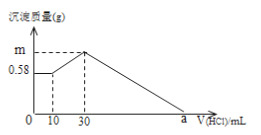
(1)沉淀的最大值,即m= ___________________g。
(2)沉淀完全溶解时,所消耗盐酸的体积a=________________mL。
【答案】 1.36g 130mL
【解析】向所得浊液中,逐滴加入0.5mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:
①0-10mL,随盐酸的体积增加,生成沉淀的质量不变,说明沉淀是Mg(OH)2,m[Mg(OH)2]=0.58g,NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,NaOH有剩余,溶液是NaCl、NaAlO2和NaOH的混合液,该阶段发生反应是:NaOH+HCl=NaCl+H2O;
②10mL处,加入10ml盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;
③10mL-30ml,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
④30mL处,NaAlO2与盐酸恰好反应,需盐酸体积为:30ml-10ml=20ml,沉淀质量达到最大,溶液为NaCl溶液;
⑤30mL-a点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Mg(OH)2+2HCl=MgCl2+2H2O;
Al(OH)3+3 HCl=AlCl3+3H2O;
⑥a点,Mg(OH)2和Al(OH)3完全反应,溶液为MgCl2、AlCl3和NaCl混合液;
(1)10mL-30ml,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
生成的Al(OH)3的物质的量为0.02L×0.5mol/L=0.01mol,质量为0.01mol×78g/mol=0.78g,
则沉淀的最大量为:0.58g+0.78g=1.36g。
(2)选30mL处,计算NaOH的质量,此时溶液为NaCl溶液,溶液中Cl-来源于原混合物中的AlCl3、MgCl2和加入的30mlHCl,溶液中Na+来源于原混合物中的NaOH,
NaAlO2+HCl+H2O=Al(OH)3↓+NaCl
0.01mol0.02L×0.5mol/L=0.01mol
由Al原子守恒得原混合物中n(AlCl3)=n(NaAlO2)=0.01mol
由Mg原子守恒得原混合物中n(MgCl2)=n[Mg(OH)2]= ![]() =0.01mol,
=0.01mol,
由Na+离子和Cl-离子守恒得:n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.01mol×3+0.03L×0.5mol/L=0.065mol;
沉淀完全溶解后溶液为MgCl2、AlCl3和NaCl混合液,a点所加盐酸相等于用于中和原混合物中的NaOH,
此时所加盐酸物质的量:n(HCl)=n(NaOH)=0.065mol,
P点所表示盐酸的体积为:V=![]() =0.13L=130mL。
=0.13L=130mL。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案