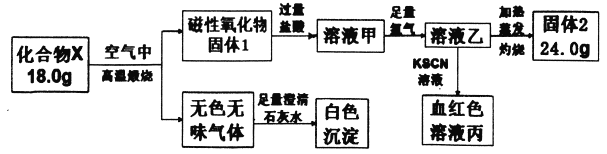
题目内容
【题目】苯硫酚(C6H5-SH)是一种用途广泛的有机合成中间体。工业上用常用氯苯(C6H5-Cl)和硫化氢(H2S)反应来制备苯硫酚,但会有副产物苯(C6H6) 生成。
I: C6H5-Cl(g)+H2S(g)![]() C6H5-SH(g)+HCl(g) △H1=-16.8 kJ/mol
C6H5-SH(g)+HCl(g) △H1=-16.8 kJ/mol
II: C6H5-Cl(g)+H2S(g)=C6H6(g)+HCl(g)+ ![]() S8(g) △H2
S8(g) △H2
反应II的焓变不易测量,现查表得如下数据:
Ⅲ: C6H5-SH(g)==C6H6(g)+ ![]() S8(g) △H3=-29.0 kJ/mol
S8(g) △H3=-29.0 kJ/mol
请回答:
(1)反应II为不可逆反应,请简述理由______________。
(2)现将一定量的氯苯和硫化氢置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20分钟测定生成物的浓度,得到图1和图2。
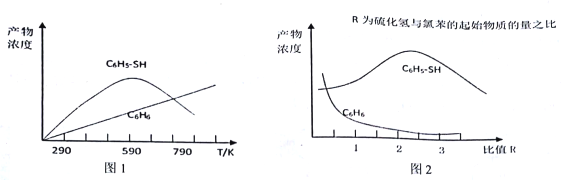
①下列说法不正确的是____________。
A.由图1可知,相同条件下反应I的活化分子百分数大于反应II 的活化分子百分数
B.图1中C6H5-SH 的浓度在590℃随温度变化的原因可能是反应II 中消耗反应物,使反应I平衡逆向移动
C.其他条件不变,由图1可知,氯苯的转化率随温度的升高而降低
D.由图2 可知,若要提高C6H5-SH 的产量,可提高硫化氢与氯苯起始物质的量之比
②590℃时,氯苯和硫化氢混合气体(体积比1:2.5,总物质的量amol)在VL的固定容积中进行反应,达到平衡时,测得容器中苯硫酚的物质的量为a/7mol,苯的物质的量为a/l4mol,则该温度下反应I的平衡常数为____。(保留两位有效数字)
③请根据图1、图2,在右图中画出恒温恒容条件下反应主产物苯硫酚的物质的量浓度随时间变化的曲线图________

(3)除了用以上方法制备苯硫酚以外,亦可电解还原苯磺酸(C6H5-SO3H,一元强酸)或苯磺酰氯来制备。以锌和石墨为电极,硫酸为电解质溶液,电解苯磺酸时的阴极反应式为_______。
【答案】 反应II △H2=-45.8kJ/mol<0,△S>0,说明其正反应是自发反应,而逆反应为非自发反应,所以反应II为不可逆反应 CD 0.86 如图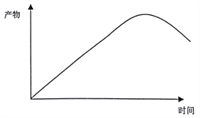 C6H5-SO3H+6H+ +6e- = C6H5-SH +3H2O
C6H5-SO3H+6H+ +6e- = C6H5-SH +3H2O
【解析】(1)本题考查热化学反应方程式的计算、化学反应进行的方向,根据III,II-I,得出△H3=△H2-△H1,求出△H2=-45.8kJ·mol-1,根据△G=△H-T△S,因为△H2<0,△S>0,说明其正反应是自发进行,而逆反应为非自发进行;(2)本题考查化学反应条件的控制、化学平衡常数的计算,①A、根据图①反应I的化学反应速率比反应II快,说明相同条件下,反应I的活化分子百分数大于反应II活化分子百分数,故A说法正确;B、根据反应I和反应II的化学反应方程式,氯苯和硫化氢都是反应物,因为反应II是不可逆反应,升高温度,反应II中消耗氯苯和硫化氢,相当于减少反应I中反应物的浓度,平衡向逆反应方向进行,苯硫酚的浓度降低,故B说法正确;C、根据图1,反应II中氯苯的转化率随温度的升高而升高,故C说法错误;D、根据图2,在提高硫化氢与氯苯起始物质的量之比时,苯硫酚的浓度反而降低,故D说法错误;②C6H5-Cl(g)+H2S(g)![]() C6H5-SH(g)+HCl(g)
C6H5-SH(g)+HCl(g)
变化物质的量: a/7 a/7 a/7 a/7
C6H5-Cl(g)+H2S(g)===C6H6(g)+HCl(g)+ ![]() S8(g)
S8(g)
变化的物质的量: a/14 a/14 a/14 a/14 开始时,氯苯的总物质的量为![]() ,硫化氢总物质的量为
,硫化氢总物质的量为![]() ,达到平衡时,氯苯的物质的量为
,达到平衡时,氯苯的物质的量为 ,硫化氢物质的量为
,硫化氢物质的量为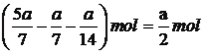 ,根据化学平衡常数的表达式,K=
,根据化学平衡常数的表达式,K= 0.86;③根据图1和图2,随着反应的进行苯硫酚的浓度增加,然后降低,因此图像是
0.86;③根据图1和图2,随着反应的进行苯硫酚的浓度增加,然后降低,因此图像是 ;(3)本题考查电极反应式的书写,根据电解原理,阴极上得到电子,化合价降低,发生还原反应,环境是酸性,因此电极反应式为 C6H5-SO3H+6H+ +6e- = C6H5-SH +3H2O。
;(3)本题考查电极反应式的书写,根据电解原理,阴极上得到电子,化合价降低,发生还原反应,环境是酸性,因此电极反应式为 C6H5-SO3H+6H+ +6e- = C6H5-SH +3H2O。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案