题目内容
12.有一真空密闭容器中,盛有amolPCl5,加热到200℃时,发生如下反应:PCl5(g)?PCl3(g)+Cl2(g),反应达平衡时,PCl5所占体积分数为M%,若在同一温度下,同一容器中,最初投入0.5amolPCl5反应达平衡时,PCl5所占体积分数为N%,则M与N的关系正确的是( )| A. | M<N | B. | 2M=N | C. | N<M | D. | M=N |
分析 该反应是气体体积增大的化学反应,增大压强,平衡向逆反应方向移动,根据压强对化学平衡的影响分析判断.
解答 解:根据PV=nRT知,R为常数,当V、T相同时,n越大,P越大;该反应是气体体积增大的反应,当投入的物质的量加倍时,则相当于增大压强,平衡向气体体积减小的方向移动,即逆反应方向移动,所以导致反应达到平衡时PCl5的转化率减小,PCl5的体积分数增大,则盛有amolPCl5,达平衡时,PCl5所占体积分数为M%大于0.5amolPCl5反应达平衡时,PCl5所占体积分数为N%,故N<M.
故选C.
点评 本题考查了外界条件对化学平衡的影响,难度中等,正确运用等效平衡是解本题的关键.

练习册系列答案
相关题目
20.金属锂在通讯和航空航天领域中有重要的应用.以某锂矿为原料制取锂的工艺流程如下图,其主要成分为Li2O、Al2O3、SiO2,另含有FeO、MgO、CaO等杂质.
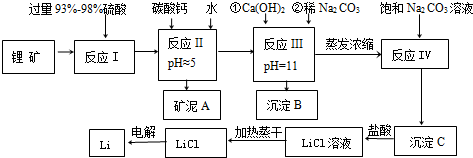
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②Li2CO3在不同温度下的溶解度如表:
请回答下列问题:
(1)锂矿中的FeO在反应 I中发生的化学反应方程式为2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O
(2)反应 II中pH的范围是4.7≤pH<9.6
(3)沉淀B中主要成分为CaCO3和Mg(OH)2(填化学式);沉淀C应使用热水 洗涤(选填“热水”或“冷水”)
(4)反应 IV发生的离子方程式为2Li++CO32-=Li2CO3
(5)电解熔融LiCl的阴极电极反应式为Li++e-=Li;阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时放电产生O2.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)锂矿中的FeO在反应 I中发生的化学反应方程式为2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O
(2)反应 II中pH的范围是4.7≤pH<9.6
(3)沉淀B中主要成分为CaCO3和Mg(OH)2(填化学式);沉淀C应使用热水 洗涤(选填“热水”或“冷水”)
(4)反应 IV发生的离子方程式为2Li++CO32-=Li2CO3
(5)电解熔融LiCl的阴极电极反应式为Li++e-=Li;阳极产生的氯气中会混有少量氧气,原因是加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时放电产生O2.
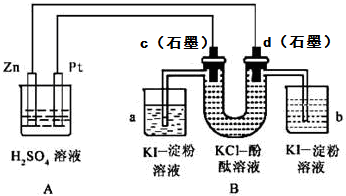
7. 加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法中正确的是( )
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法中正确的是( )
 加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法中正确的是( )
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH═5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法中正确的是( )| A. | 电解过程中OH-从a极区通过离子交换膜c进入b极区 | |
| B. | 随着电解进行,KOH溶液浓度会逐渐减小 | |
| C. | 当阳极有0.1mol I-放电时,阴极生成6.72LH2 | |
| D. | a电极反应式:I--6e-+6OH-═IO3-+3H2O,a极区的KI最终转变为KIO3 |

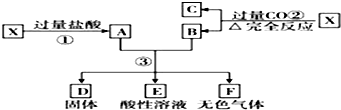
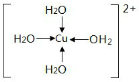 ;再加入无水酒精又看到的现象是
;再加入无水酒精又看到的现象是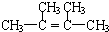 ;
;