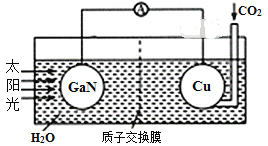
题目内容
【题目】下列实验与对应的图象符合的是( )
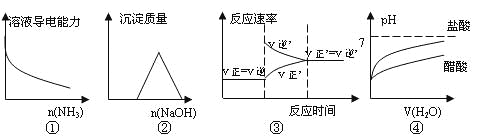
A.①是向一定量的CH3COOH溶液中通入氨气
B.②是向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量
C.③是对于达到平衡状态的![]() 反应,在t1时缩小容器,并在t2时又达到平衡。
反应,在t1时缩小容器,并在t2时又达到平衡。
D.④是将pH=2的盐酸和醋酸分别加水稀释
【答案】D
【解析】
A.醋酸是弱电解质,在溶液中离子浓度较小,向醋酸溶液中通入NH3至过量,醋酸和氨气反应生成强电解质醋酸铵,离子浓度增大,溶液的导电能力增大,故A错误;
B.向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量,发生的化学反应为:HCl+NaOH=NaCl+H2O 、AlCl3+3NaOH=Al(OH)3↓+3NaCl、Al(OH)3+NaOH=NaAlO2+2H2O,根据反应方程式知,生成沉淀量最大时所用的氢氧化钠是沉淀完全消失时的3倍,故B错误;
C.反应N2(g)+3H2(g)![]() 2NH3(g)是一个反应前后气体体积减小的可逆反应,缩小容器体积,容器内气体的压强增大,导致正逆反应速率都增大,但正反应速率大于逆反应速率,平衡向正反应方向移动,当正逆反应速率相等时,再次达到平衡状态,故C错误;
2NH3(g)是一个反应前后气体体积减小的可逆反应,缩小容器体积,容器内气体的压强增大,导致正逆反应速率都增大,但正反应速率大于逆反应速率,平衡向正反应方向移动,当正逆反应速率相等时,再次达到平衡状态,故C错误;
D.pH=2的盐酸和醋酸中,醋酸是弱电解质、氯化氢是强电解质,所以醋酸的浓度大于盐酸,稀释相同的倍数,醋酸中氢离子浓度大于盐酸中氢离子浓度,所以醋酸的pH变化小于盐酸的变化,故D正确;
故选D。

练习册系列答案
相关题目