��Ŀ����
����Ŀ���о�����NOx��SO2����������Ҫ�ɷ֡�
I��NOx��Ҫ��Դ������β�����������û�ѧ����������ת��Ϊ���������ʡ�
��֪��N2(g)+O2(g)![]() 2NO(g) ��H=+180 kJ�� mol��1
2NO(g) ��H=+180 kJ�� mol��1
2CO(g)+O2(g)![]() 2CO2(g) ��H=��564 kJ�� mol��1
2CO2(g) ��H=��564 kJ�� mol��1
(1)2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ��H=___________���÷�Ӧ��___________�����Է�����(����¡����¡��������¶ȡ�)
2CO2(g)+N2(g) ��H=___________���÷�Ӧ��___________�����Է�����(����¡����¡��������¶ȡ�)
(2)T��ʱ���������ʵ�����NO��CO�����ݻ�Ϊ2L���ܱ������У������¶Ⱥ�������䣬��Ӧ����0��5min��NO�����ʵ�����ʱ��仯����ͼ��ʾ��

����֪��ƽ��ʱ����ķ�ѹ=����������������ϵ����ѹǿ��T��ʱ�ﵽƽ�⣬��ʱ��ϵ����ѹǿΪ��=14MPa����T��ʱ�÷�Ӧ��ѹ��ƽ�ⳣ��Kp=___________MPa��1��ƽ������������г���NO��CO2��0.1mol��ƽ�⽫___________(��������ҡ���")�ƶ�
��15minʱ�����ı���練Ӧ����������n(NO)������ͼ��ʾ�ı仯����ı������������___________(����ĸ)
A������ B������COŨ�� C��������� D��С�������
��SO2��Ҫ��Դ��ú��ȼ�ա�ȼ����������������Ǽ��ٴ����к�������Ⱦ�Ĺؼ���
(1)��֪��������ĵ��볣��ΪKa1=2.0��10��2��Ka2=6.0��10��7����NaSO3��Һ��___________(����ԡ��������ԡ����ԡ�)
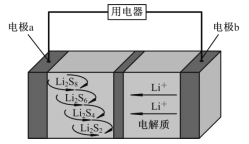
(2)��ͼ��ʾ�ĵ��װ�ã��ɽ������е�NO��SO2ת��Ϊ����泥��Ӷ�ʵ�ַ����Ļ��������á�ͨ��NO�ĵ缫��ӦʽΪ___________����ͨ���N���Ϊ4.48L(�����)��������һ���缫ͨ��SO2������������ӦΪ__________g��

���𰸡���744 kJ��mol��1 ���� 0.125(��1/8) �� BD ���� 6H����NO��5e��===NH4+��H2O 32
��������
���ݸ�˹���ɺ���G=��HT��S<0��𣻸�������ʽ, ��ѧƽ�ⳣ��K ��Qc�Ĺ�ϵ�����жϣ����� 15minʱ,�ı�ijһ����,NO�����ʵ�������,˵��ƽ��������Ӧ�����ƶ�,��ϻ�ѧƽ���Ӱ�����ط���������HSO3�ĵ���ƽ�ⳣ����ˮ��ƽ�ⳣ����С�жϣ����ݵ��װ�õ�ʧ������Ŀ�غ���м��㡣
��1�����ݸ�˹���ɢ�N2(g)+O2(g)![]() 2NO(g) ��H=+180 kJ�� mol��1 ��2CO(g)+O2(g)
2NO(g) ��H=+180 kJ�� mol��1 ��2CO(g)+O2(g)![]() 2CO2(g) ��H=��564 kJ�� mol��1,���ٵã�2NO(g)+2CO(g)
2CO2(g) ��H=��564 kJ�� mol��1,���ٵã�2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ��H= (564180)kJmol1=744kJmol1���÷�ӦΪ���������С�ķ��ȷ�Ӧ������H<0����S<0�����¶ȴ��ڵ�����������G=��HT��S<0�����Է����У��ʴ�Ϊ��744kJmol1�����£�
2CO2(g)+N2(g) ��H= (564180)kJmol1=744kJmol1���÷�ӦΪ���������С�ķ��ȷ�Ӧ������H<0����S<0�����¶ȴ��ڵ�����������G=��HT��S<0�����Է����У��ʴ�Ϊ��744kJmol1�����£�
(2)����ͼ1֪,2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)��
2CO2(g)+N2(g)��
��ʼ(mol) 0.4 0.4 0 0
ת��(mol) 0.2 0.2 0.2 0.1
ƽ��(mol) 0.2 0.2 0.2 0.1
����ֵ���������ֱ��ǣ�![]() ��
��![]() ��
��![]() ��
��![]() ��,Kp=
��,Kp=![]() =(14��
=(14��![]() )2��(14
)2��(14![]() )/ [(14��
)/ [(14��![]() )2��(14��
)2��(14��![]() )2]=0.125�����ݢٵķ���,��ѧƽ�ⳣ��K=
)2]=0.125�����ݢٵķ���,��ѧƽ�ⳣ��K= =5,���������г���NO��CO2��0.3mol����ʱ��Ũ����Qc=
=5,���������г���NO��CO2��0.3mol����ʱ��Ũ����Qc= =5=K�����ƽ�ⲻ�ƶ����ʴ�Ϊ��0.125������
=5=K�����ƽ�ⲻ�ƶ����ʴ�Ϊ��0.125������
��15minʱ���ı�ijһ���أ�NO�����ʵ������٣�˵��ƽ��������Ӧ�����ƶ���
A. ����Ӧ�Ƿ��ȷ�Ӧ�����£�ƽ�����淴Ӧ�����ƶ���NO�����ʵ�������A����
B. ����CO��Ũ�ȣ�ƽ��������Ӧ�����ƶ���NO�����ʵ�����С����B��ȷ��
C. �����������ѧƽ�ⲻ�ƶ�����C����
D. ��С������������൱������ѹǿ��ƽ��������Ӧ�����ƶ���NO���ʵ�����С����D��ȷ��
�ʴ�Ϊ��BD��
��(1)����HSO3��ˮ�ⳣ��K=Kw/Ka1=5.0��1013<Ka2=6.0��107,˵��HSO3�ĵ���ƽ�ⳣ������ˮ��ƽ�ⳣ������HSO3����Һ�����ԣ��𰸣����ԣ�/span>
(2)���ݵ��װ�ã�NO��SO2ת��Ϊ����泥�˵��NOת����NH4+����NO�������Ϸ�����ӦNO+6H++5e=NH4++H2O��������ӦʽΪSO2+2H2O2e=4H++SO42,���ݵ�ʧ������Ŀ�غ㣬��2NO10e5SO2����SO2�����ʵ���Ϊ��n(SO2)=5/2n(NO)=4.48L/22.4Lmol-1��5/2=0.5mol��SO2������Ϊ64g/mol��0.5mol=32g���ʴ�Ϊ��6H����NO��5e��===NH4+��H2O��32��

 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�