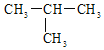题目内容
【题目】青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157°C,热稳定性差。已知:乙醚沸点为35°C。提取青蒿素的主要工艺为:
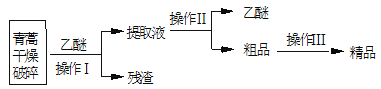
下列有关此工艺操作错误的是( )
A.破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率
B.操作Ⅰ需要用到的玻璃仪器有漏斗、玻璃棒、烧杯
C.操作Ⅱ是蒸馏,利用了乙醚与青蒿素的沸点相差较大
D.操作Ⅲ的主要过程加水溶解,蒸发浓缩、冷却结晶、过滤
【答案】D
【解析】
对青蒿进行干燥破碎,可以增大青蒿与乙醚的接触面积,提高青蒿素的浸取率,用乙醚对青蒿素进行浸取后,过滤,可得滤液和滤渣,提取液经过蒸馏后可得青蒿素的粗品,对粗品可加95%的乙醇,浓缩、结晶、过滤可得精品,据此分析作答。
根据上述分析可知,
A. 破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率,故A正确;
B. 操作Ⅰ为过滤,需要用到的玻璃仪器有漏斗、玻璃棒、烧杯,故B正确;
C. 操作Ⅱ是蒸馏,利用了乙醚与青高素的沸点相差较大,故C正确;
D. 根据给定信息可知,青蒿素在水中几乎不溶,因此操作Ⅲ的主要过程不是加水溶解,可加95%的乙醇溶解,再进行蒸发浓缩、冷却结晶、过滤,故D错误;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O
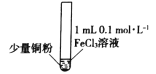
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀