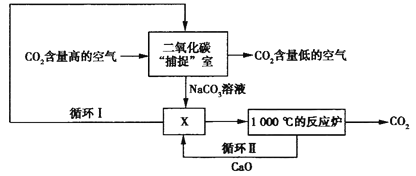
题目内容
【题目】某化学研究性学习小组用CO还原Fe2O3 , 并在实验结束后用磁铁吸出生成的黑色粉末X进行探究. [探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
I.CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4 , 也能被磁铁吸引.
II.Fe3O4+8H+=2Fe3++Fe2++4H2O
(1)[猜想假设]黑色粉末X的组成可能是、 , 或二者的混合物. [实验探究]
编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管中,注入足量的一定浓度的盐酸,微热 | 黑色粉末逐渐溶解,同时有气泡产生,溶液呈浅绿色. |
② | 向上述试管中滴加几滴KSCN溶液,振荡 | 溶液没有呈现红色 |
实验①中产生气泡的离子方程式为 .
(2)根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4 , 请用离子方程式解释原因: .
(3)为了证明黑色粉末X中是否含有Fe3O4 , 该小组进行如图所示实验: 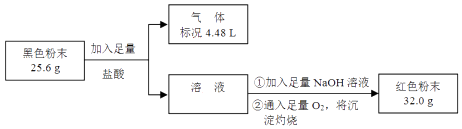
请根据数据分析说明黑色粉末X中是否含有Fe3O4 . .
【答案】
(1)Fe;Fe3O4;Fe+2H+═Fe2++H2↑
(2)Fe3O4+8H+═2Fe3++Fe2++4H2O、Fe+2Fe3+═3Fe2+
(3)方法1:因为32gFe2O3中含Fe元素为22.4g,而25.6g>22.4g,所以X中还含有O元素,还含有Fe3O4; 方法2:因为产生产生4.48L氢气,需要Fe单质为11.2g,而25.6g>11.2g,所以X中还含有Fe3O4
【解析】解:[猜想假设] (1)CO还原Fe2O3为Fe生成的黑色粉末X,Fe、Fe3O4黑色且能被磁铁吸引,则磁性黑色粉末X可能是Fe、Fe3O4、或二者的混合物;所以答案是:Fe、Fe3O4;黑色粉末X与盐酸反应有气泡产生,溶液呈浅绿色,说明铁与盐酸反应生成氢气和氯化亚铁,离子反应为:Fe+2H+═Fe2++H2↑;所以答案是:Fe+2H+═Fe2++H2↑;(2)黑色粉末X与盐酸反应,若铁足量,少量的Fe3O4 , 加盐酸溶解发生反应:Fe3O4+8H+═2Fe3++Fe2++4H2O,因为铁足量,将生成的三价铁还原为亚铁离子:Fe+2Fe3+═3Fe2+ , 不能使KSCN溶液显色,故根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4;所以答案是:Fe3O4+8H+═2Fe3++Fe2++4H2O、Fe+2Fe3+═3Fe2+;(3)方法1:生成的红色粉末为Fe2O332.0g,因为32 g Fe2O3中含Fe元素为 ![]() g=22.4 g,而25.6 g>22.4 g,所以X中还含有O元素,还含有Fe3O4;方法2:因为产生4.48L氢气,氢气为0.2mol,Fe单质为0.2mol×56g/mol=11.2 g,而25.6 g>11.2 g,所以X中还含有Fe3O4;所以答案是:方法1:因为32 g Fe2O3中含Fe元素为22.4 g,而25.6 g>22.4 g,所以X中还含有O元素,还含有Fe3O4;方法2:因为产生产生4.48L氢气,需要Fe单质为11.2 g,而25.6 g>11.2 g,所以X中还含有Fe3O4 .
g=22.4 g,而25.6 g>22.4 g,所以X中还含有O元素,还含有Fe3O4;方法2:因为产生4.48L氢气,氢气为0.2mol,Fe单质为0.2mol×56g/mol=11.2 g,而25.6 g>11.2 g,所以X中还含有Fe3O4;所以答案是:方法1:因为32 g Fe2O3中含Fe元素为22.4 g,而25.6 g>22.4 g,所以X中还含有O元素,还含有Fe3O4;方法2:因为产生产生4.48L氢气,需要Fe单质为11.2 g,而25.6 g>11.2 g,所以X中还含有Fe3O4 .