题目内容
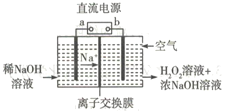
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂、鞣革还原剂、脱氯剂等.它受热、遇酸易分解.它有多种制备方法,其中硫化碱法为:向热的硫化钠和亚硫酸钠混合液中通入二氧化硫,经吸硫、蒸发、结晶,制得硫代硫酸钠晶体.制备过程中发生的主要反应如下: Na2S+H2O+SO2→Na2SO3+H2S …(i)
2H2S+SO2→3S+2H2O …(ii)
S+Na2SO3 ![]() Na2S2O3 …(iii)
Na2S2O3 …(iii)
(1)已知Na2S2O3分解反应是吸热反应,由此可得出:该分解反应中,反应物断裂化学键所吸收的总能量(填“大于”、“小于”或“等于”)生成物形成化学键所放出的总能量.
(2)Na2S2O3具有还原性,判断依据是、(至少写出两条).
(3)上述反应i~iii总反应的化学方程式为 . 制备过程中,即使将反应物的用量按化学方程式的计量数进行配比,反应后各反应物仍有剩余,这说明该过程中存在 .
(4)为了保证硫代硫酸钠的产量,生产中通入的SO2不能过量,原因是 .
【答案】
(1)大于
(2)硫元素化合价为+2价,没有达到最高价;可用作脱氯剂
(3)2Na2S+Na2SO3+3SO2→3Na2S2O3;可逆反应
(4)SO2过量,溶液显酸性,Na2S2O3遇酸易分解
【解析】解:(1)反应中断键时吸收的能量比形成化学键时放出的能量高,则反应是吸热反应,故反应物断裂化学键所吸收的总能量大于生成物形成化学键所放出的总能量,所以答案是:大于;(2)Na2S2O3具有还原性,判断依据是:硫元素化合价为+2价,没有达到最高价,可用作脱氯剂等,所以答案是:硫元素化合价为+2价,没有达到最高价;可用作脱氯剂;(3)Na2S+H2O+SO2→Na2SO3+H2S …(i) 2H2S+SO2→3S+2H2O …(ii)
S+Na2SO3 ![]() Na2S2O3 …(iii)2×i+ii+iii,得总反应方程式为2Na2S+Na2SO3+3SO2→3Na2S2O3;可逆反应的特点是反应物不能完全转化为生成物,反应后各反应物仍有剩余,故说明该过程中存在可逆反应,所以答案是:2Na2S+Na2SO3+3SO2→3Na2S2O3;可逆反应;(4)若SO2过量,溶液显酸性,Na2S2O3遇酸易分解,故生产中通入的SO2不能过量,所以答案是:SO2过量,溶液显酸性,Na2S2O3遇酸易分解.
Na2S2O3 …(iii)2×i+ii+iii,得总反应方程式为2Na2S+Na2SO3+3SO2→3Na2S2O3;可逆反应的特点是反应物不能完全转化为生成物,反应后各反应物仍有剩余,故说明该过程中存在可逆反应,所以答案是:2Na2S+Na2SO3+3SO2→3Na2S2O3;可逆反应;(4)若SO2过量,溶液显酸性,Na2S2O3遇酸易分解,故生产中通入的SO2不能过量,所以答案是:SO2过量,溶液显酸性,Na2S2O3遇酸易分解.
【考点精析】掌握反应热和焓变是解答本题的根本,需要知道在化学反应中放出或吸收的热量,通常叫反应热.

【题目】某化学研究性学习小组用CO还原Fe2O3 , 并在实验结束后用磁铁吸出生成的黑色粉末X进行探究. [探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
I.CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4 , 也能被磁铁吸引.
II.Fe3O4+8H+=2Fe3++Fe2++4H2O
(1)[猜想假设]黑色粉末X的组成可能是、 , 或二者的混合物. [实验探究]
编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管中,注入足量的一定浓度的盐酸,微热 | 黑色粉末逐渐溶解,同时有气泡产生,溶液呈浅绿色. |
② | 向上述试管中滴加几滴KSCN溶液,振荡 | 溶液没有呈现红色 |
实验①中产生气泡的离子方程式为 .
(2)根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4 , 请用离子方程式解释原因: .
(3)为了证明黑色粉末X中是否含有Fe3O4 , 该小组进行如图所示实验: 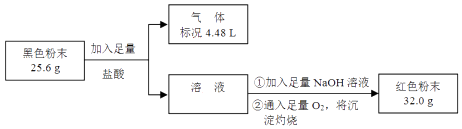
请根据数据分析说明黑色粉末X中是否含有Fe3O4 . .