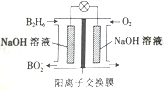
题目内容
【题目】在过氧化钠与水反应中,发生氧化反应和还原反应的物质的物质的量之比是( )
A. 1∶1 B. 1∶2 C. 2∶1 D. 8∶53
【答案】A
【解析】
过氧化钠与水反应产生NaOH和O2,反应方程式是2Na2O2+2H2O=4NaOH+O2↑。在这个反应中,Na2O2中的O原子,一部分由-1价变为反应后O2中的0价,化合价升高,失去电子,发生氧化反应;一部分由-1价变为反应后NaOH中的-2价,化合价降低,获得电子,发生还原反应,过氧化钠既作氧化剂,又作还原剂,水中O元素化合价不变,所以发生氧化反应和还原反应的物质的物质的量之比是1:1,故合理选项是A。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】某化学研究性学习小组用CO还原Fe2O3 , 并在实验结束后用磁铁吸出生成的黑色粉末X进行探究. [探究目的]分析黑色粉末X的组成,并进行相关实验.
[查阅资料]
I.CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4 , 也能被磁铁吸引.
II.Fe3O4+8H+=2Fe3++Fe2++4H2O
(1)[猜想假设]黑色粉末X的组成可能是、 , 或二者的混合物. [实验探究]
编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管中,注入足量的一定浓度的盐酸,微热 | 黑色粉末逐渐溶解,同时有气泡产生,溶液呈浅绿色. |
② | 向上述试管中滴加几滴KSCN溶液,振荡 | 溶液没有呈现红色 |
实验①中产生气泡的离子方程式为 .
(2)根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4 , 请用离子方程式解释原因: .
(3)为了证明黑色粉末X中是否含有Fe3O4 , 该小组进行如图所示实验: 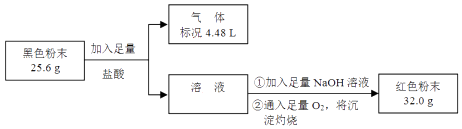
请根据数据分析说明黑色粉末X中是否含有Fe3O4 . .
【题目】依据下表有关铁难溶化合物的溶度积,有关说法正确的是
化合物 | 溶度积(25℃) | 化合物 | 溶度积(25℃) |
FeCO3 | 3.2×10-11 | Fe(OH)3 | 4.0×10-38 |
Fe(OH)2 | 8.0×10-11 | FeS | 6.3×10-18 |
A. 在c(CO32-)=0.1 mol·L-1的溶液中,c(Fe2+)≥3.2×10-10 mol·L-1
B. 将FeCl3和 FeCl2溶液分别调至PH=10,则c(Fe2+)< c(Fe3+)
C. 增加溶液的酸性,有利于将Fe2+沉淀为FeS和FeCO3
D. 将反应液中的Fe2+氧化为 Fe3+有利于将铁从溶液中除尽