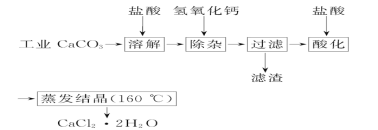
题目内容
【题目】高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)![]() Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为K=
Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为K=![]() ,已知1100℃时K=0.263
,已知1100℃时K=0.263
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值________;平衡常数K值___________ (选填“增大”“减小”或“不变”)。
(2)1100℃时测得高炉中c(CO2)=0.025mol·L﹣1、c(CO)=0.1mol·L﹣1,在这种情况下,该反应是否处于化学平衡状态_________ (选填“是”或“否”),此时,化学反应速率是υ(正)_______ υ(逆)(选填“大于”“小于”或“等于”),其原因是____________。
(3)能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.0 kJ/mol
Ⅱ.CO(g)+2H2(g)=CH3OH(g)ΔH=-129.0 kJ/mol
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式__________。
【答案】增大 增大 否 大于 因为温度不变,K不变,为增大K平衡应向正向移动,所以υ(正)>υ(逆) CH4(g)+H2O(g)![]() CH3OH(g)+H2(g)ΔH=+77.0 kJ·mol-1
CH3OH(g)+H2(g)ΔH=+77.0 kJ·mol-1
【解析】
根据平衡常数K和浓度商的大小分析平衡的移动方向;根据盖斯定律计算反应热,并书写热化学方程式。
(1)正反应吸热,升高温度平衡向正反应方向移动,则高炉内CO2和CO体积比值增大,平衡常数K值增大,
故答案为:增大;增大;
(2)c(CO2)=0.025mol/L,c(CO)=0.1mol/L,Q=![]() =0.25<0.263,该反应不处于化学平衡状态,且反应向正方向进行,υ(正)>υ(逆),
=0.25<0.263,该反应不处于化学平衡状态,且反应向正方向进行,υ(正)>υ(逆),
故答案为:否; 大于 ;因为温度不变,K不变,为增大K平衡应向正向移动,所以υ(正)>υ(逆);
(3)依据盖斯定律结合题干热化学方程式计算得到;①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ/mol;②CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol
①+②得到CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为:
CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0kJ/mol;
故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=+77.0kJ/mol。

【题目】金属锰及其化合物在工农业生产和科研领域具有广泛的应用。
Ⅰ.溶液中的Mn2+可被酸性(NH4)2S2O8溶液氧化为 MnO4-,该方法可用于检验Mn2+。
(1)用酸性(NH4)2S2O8溶液检验Mn2+时的实验现象为________。
(2)该反应的离子方程式为________。
(3)(NH4)2S2O8可视为由两分子硫酸缩合所得,则H2S2O8的结构式为 ________。
Ⅱ.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn的工艺流程如下图所示。

难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度积常数 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
(4)“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为___________;该过程中浸出时间和液固比对锰浸出率的影响分别如下图所示。

则适宜的浸出时间和液固比分别为____________、____________。
(5)若“酸浸”后所得滤液中c(Mn2+)=0.18molL-1,则应“调pH”的范围为_________。
(6)“煅烧”反应中氧化剂与还原剂的物质的量之比为________。“还原”时发生的置换反应在化学上又叫作__________。