题目内容
【题目】室温下,用0.10mol/LKOH溶液滴定10.00mL0.10mol/LH2C2O4(二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).请回答: 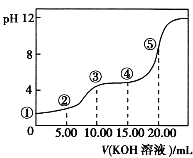
(1)点①所示溶液中,Kw= .
(2)点②所示溶液中的电荷守恒式为 .
(3)点③所示溶液中所有离子的浓度由大到小的顺序为 .
(4)点④所示溶液中的物料守恒式为0.10mol/L= .
【答案】
(1)1×10﹣14
(2)c(H+)+c(K+)=c(HC2O4﹣)+c(OH﹣)+2c(C2O42﹣)
(3)c(K+)>c(HC2O4﹣)>c(H+)>c(C2O42﹣)>c(OH﹣)
(4)c(HC2O4﹣)+c(H2C2O4)+c(C2O42﹣)+c(K+)
【解析】解:(1)在任何的溶液中均存在水的离子积常数,室温下水的离子积为:KW=1×10﹣14,
所以答案是:1×10﹣14;(2)溶液中所有阳离子所带的正电荷总数一定等于阴离子所带的负电荷总数,即c(H+)+c(K+)=c(HC2O4﹣)+c(OH﹣)+2c(C2O42﹣),
所以答案是:c(H+)+c(K+)=c(HC2O4﹣)+c(OH﹣)+2c(C2O42﹣);(3)点③时两溶液恰好完全反应生成了KHC2O4,溶液显酸性,HC2O4﹣的电离程度大于水解程度,则溶液中离子浓度关系为:c(K+)>c(HC2O4﹣)>c(H+)>c(C2O42﹣)>c(OH﹣);
所以答案是:c(K+)>c(HC2O4﹣)>c(H+)>c(C2O42﹣)>c(OH﹣);(4)点④所示的溶液的体积25mL,根据物料守恒:c(HC2O4﹣)+c(H2C2O4)+c(C2O42﹣)=0.10mol/L× ![]() =0.04mol/L;c(K+)=0.10mol/L×
=0.04mol/L;c(K+)=0.10mol/L× ![]() =0.06mol/L,所以0.10molL﹣1=c(HC2O4﹣)+c(H2C2O4)+c(C2O42﹣)+c(K+),
=0.06mol/L,所以0.10molL﹣1=c(HC2O4﹣)+c(H2C2O4)+c(C2O42﹣)+c(K+),
所以答案是:c(HC2O4﹣)+c(H2C2O4)+c(C2O42﹣)+c(K+).