题目内容
【题目】以下是由乙烯合成乙酸乙酯的几种可能的合成路线:

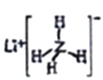
(1)乙烯中官能团的结构简式是___,乙醇中含氧官能团的名称是____。
(2)请写出上述几种路线中涉及到的有机化学反应基本类型,反应①:____,反应②:____。
(3)请写出④、⑤反应的化学方程式:
④__________________________;
⑤____________________________。
(4)乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用下列装置来制备。完成下列填空:

①实验时,加入药品的顺序是____,该反应进行的比较缓慢,为了提高反应速率,一般要加入浓硫酸做催化剂,并____。
②反应结束后,将试管中收集到的产品倒入分液漏斗中,____、静置,然后分液。
③若用b装置制备乙酸乙酯,其缺点有____(答一条即可)。
【答案】 ![]() 羟基 加成反应 氧化反应 2CH3CH2OH+O2
羟基 加成反应 氧化反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3CH2OH+CH3COOH
2CH3CHO+2H2O CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O 乙醇、浓硫酸、乙酸 加热 振荡 原料损失较大或易发生副反应等
CH3COOCH2CH3+H2O 乙醇、浓硫酸、乙酸 加热 振荡 原料损失较大或易发生副反应等
【解析】由合成流程可知,①为乙烯与水的加成反应生成乙醇,②为乙烯的氧化反应生成乙醛,③为乙烯的氧化反应生成乙酸,④为乙醇的氧化反应生成乙醛,⑤为乙醇与乙酸的酯化反应生成乙酸乙酯,以此来解答;
(4)①为防止酸液飞溅,应先加入乙醇,然后再加入浓硫酸和乙酸;该反应进行的比较缓慢,为了提高反应速率,一般要加入浓硫酸做催化剂,并加热;
②乙酸乙酯与饱和碳酸钠溶液分层,应充分振荡后静置分层;
③图b直接加热时乙醇、乙酸易挥发,且乙醇可发生分子间脱水反应,而图a中水浴加热可控制温度,以此来解答。
(1)乙烯中含有碳碳双键,结构简式为![]() ;乙醇中含氧官能团的名称是羟基;
;乙醇中含氧官能团的名称是羟基;
(2)根据以上分析可知反应①是加成反应,反应②是氧化反应;
(3)反应④的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;反应⑤的方程式为CH3CH2OH+CH3COOH
2CH3CHO+2H2O;反应⑤的方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(4)①浓硫酸溶于水放热,密度大于水,为防止酸液飞溅,应先加入乙醇,然后再加入浓硫酸和乙酸,如先加浓硫酸会出现酸液飞溅的可能现象;该反应进行的比较缓慢,为了提高反应速率,一般要加入浓硫酸做催化剂,并加热;
②反应结束后,将试管中收集到的产品倒入分液漏斗中,振荡、静置,然后分液;
③若用b装置制备乙酸乙酯,其缺点有原料损失较大、易发生副反应等。

 名校课堂系列答案
名校课堂系列答案【题目】根据问题填空:
(1)CO(g)+2H2(g)CH3OH(g)△H
如表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H0(填“>”、“=”或“<”).能够说明某温度下该反应是平衡状态的是
A.体系的压强不变 B.密度不变 C.混合气体的相对分子质量 D.c(CO)=c(CH3OH)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=(保留3为有效数字)
(2)在某温度和压强下,将一定量H2和O2充入密闭容器发生反应:
2H2(g)+O2(g)2H2O(g)△H=﹣241.8KJ/mol,平衡后压缩容器体积至原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填序号):
,其他条件不变,对平衡体系产生的影响是 (填序号):
a.平衡常数K增大; b.正反应速率加快,逆反应速率减慢; c.重新平衡c(H2)/c(H2O)减小.