题目内容
【题目】[化学-选修5:有机化学基础]2017年治疗膀胱癌的有机小分子药物Aminolevulinic acid被批准使用,其合成路线如下:

已知:
请回答:
(1)A的名称为________,G中含氧官能团的名称为____________________________。
(2)⑤的反应类型为____________________,H的分子式为_____________________________。(3)①的化学方程式为__________________________________________。
(4)④的化学方程式为______________________________________________。
(5)D的同分异构体中,同时满足下列条件的共有____种(不含立体异构);
a.能与Na反应产生气体
b.既能发生银镜反应,又能发生水解反应
其中核磁共振氧谐有4组峰的物质的结构简式为________________(任写一种)。
(6)参照上述合成路线,设计由2-甲基丙酸和甲醇为起始原料制备2-甲基丙烯酸甲酯的合成路线(无机试剂任选)______________________________________________________。
【答案】 1,4—戊二醇 羰基、酯基 消去反应 C6H7O4N ![]()
![]() 12
12  或HCOOC(CH3)2CH2OH
或HCOOC(CH3)2CH2OH ![]()
【解析】考查有机物的推断和合成,根据G的结构简式,反应⑥类型为酯化反应,因此推出F的结构简式为 ,根据已知信息,反应⑤发生消去反应,推出E的结构简式为
,根据已知信息,反应⑤发生消去反应,推出E的结构简式为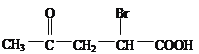 ,根据E的结构简式,推出C的结构简为
,根据E的结构简式,推出C的结构简为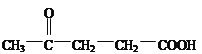 ,对比B和C的分子式,B比C少一个O原子,即B生成C发生的氧化反应,即B的结构简式为
,对比B和C的分子式,B比C少一个O原子,即B生成C发生的氧化反应,即B的结构简式为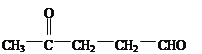 ,对比A和B的分子式,A比B多4个H,A生成B发生的氧化反应,即A的结构简式为CH3CH(OH)CH2CH2CH2OH,(1)根据上述分析,以及醇的命名原则,A的名称为1,4-戊二醇;根据G的结构简式,含有的官能团是羰基、碳碳双键、酯基,其中含氧官能团是羰基和酯基;(2)⑤的反应类型为消去反应,H的分子式为C6H7O4N;(3)①发生氧化反应,其反应方程式为
,对比A和B的分子式,A比B多4个H,A生成B发生的氧化反应,即A的结构简式为CH3CH(OH)CH2CH2CH2OH,(1)根据上述分析,以及醇的命名原则,A的名称为1,4-戊二醇;根据G的结构简式,含有的官能团是羰基、碳碳双键、酯基,其中含氧官能团是羰基和酯基;(2)⑤的反应类型为消去反应,H的分子式为C6H7O4N;(3)①发生氧化反应,其反应方程式为![]() ;(4)③是还原反应,羰基与H2反应生成羟基,D的结构简式为CH3CH(OH)CH2CH2COOH,反应④生成高分子化合物,即发生缩聚反应,其化学反应方程式为
;(4)③是还原反应,羰基与H2反应生成羟基,D的结构简式为CH3CH(OH)CH2CH2COOH,反应④生成高分子化合物,即发生缩聚反应,其化学反应方程式为![]() ;(5)能与Na反应产生气体,说明含有羟基或羧基,既能发生银镜反应,又能发生水解反应,说明是甲酸某酯,根据D的分子式,应含有羟基,符合条件的同分异构体有:
;(5)能与Na反应产生气体,说明含有羟基或羧基,既能发生银镜反应,又能发生水解反应,说明是甲酸某酯,根据D的分子式,应含有羟基,符合条件的同分异构体有: (羟基有4种位置)、
(羟基有4种位置)、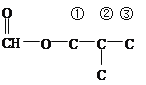 (羟基有3种位置)、
(羟基有3种位置)、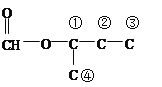 (羟基有4个位置)、
(羟基有4个位置)、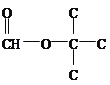 (羟基只有一种位置),共有12种,核磁共振氢谱有4组峰,说明有4种不同氢原子,因此符合结构简式有
(羟基只有一种位置),共有12种,核磁共振氢谱有4组峰,说明有4种不同氢原子,因此符合结构简式有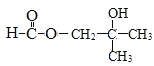 或HCOOC(CH3)2CH2OH;(6)2-甲基丙烯酸甲酯的结构简式为CH2=C(CH3)-COOCH3,此酯应有2-甲基丙烯酸与甲醇发生酯化反应得到,根据上述合成路线,得到:
或HCOOC(CH3)2CH2OH;(6)2-甲基丙烯酸甲酯的结构简式为CH2=C(CH3)-COOCH3,此酯应有2-甲基丙烯酸与甲醇发生酯化反应得到,根据上述合成路线,得到:![]() 。
。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:
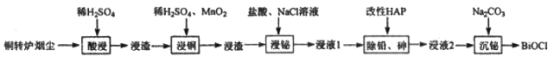
请回答:
(1)Bi位于第六周期,其原子结构示意图为__________________________________。
(2)向“酸浸”所得浸液中加入Zn粉,充分反应后过滤,从溶液中获得ZnSO4·7H2O的操作为__________、过滤、洗涤、干燥。
(3)“浸铜”时,有单质硫生成,其离子方程式为____________________________。
(4)“浸铋”时,温度升高,铋的浸出率降低,其原因为____________________________。
(5)“除铅、砷”时,可以采用以下两种方法。
①加入改性HAP。浸液1与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
L/S | 125:1 | 50:1 | 25:1 | 15:1 |
Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
As3+去除率/% | 98.79 | 98.92 | 98.34 | 99.05 |
m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
实验中应采用的L/S=_________________________。
②铁盐氧化法,向浸液1中加入Fe2(SO4)3,并调节pH,生成FeAsO4沉淀。欲使溶液中c(AsO42-)<10-9mol/L且不产生Fe(OH)3沉淀,应控制pH的范围为__________。
已知:1g2=0.3:;FeAsO4、Fe(OH)3的Ksp分别为5×10-23、4×10-38。
(6)“沉铋“时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为___________________。
【题目】T K时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g)![]() Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 2 | 4 | 6 | 8 |
n(Cl2) / mol | 0 | 0.16 | 0.19 | 0. 20 | 0.20 |
下列说法正确的是( )
A. 反应在前2 s 的平均速率v(CO)=0.080mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(Cl2) =0.11mol·L-1,则反应的ΔH<0
C. T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,达到平衡前v正>v逆
D. T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率为80%





