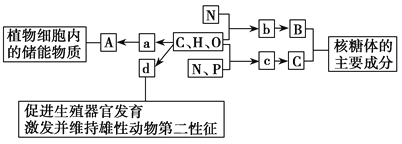
��Ŀ����
����Ŀ����1��3-����ϩ���嵥��1��1�ӳ�ʱ���䷴Ӧ�����������仯���£�

��ͬ��Ӧ�����£�������ͬʱ����������������±���
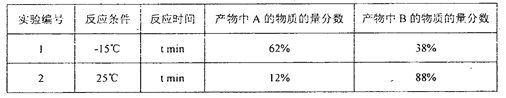
���������������
A. ����A��B��Ϊͬ���칹�壬���м�������A��B�ķ�Ӧ���ྺ��
B. ��ͬ�������ɻ����м���C���ɲ���A�����ʸ���
C. ʵ��1�ⶨ�������ʱ����ϵ����ƽ��״̬
D. ʵ��1��t minʱ���������¶���25�棬���ֲ���A�ᾭ�����м���Cת���ɲ���B
���𰸡�C
����������������1��3-����ϩ���嵥��1��1�ӳ�ʱ�ķ�Ӧ�����������仯ʾ��ͼ��֪���÷�Ӧ�������ɻ�Ϊͬ���칹������ֲ���A��B�����м�������A��B�ķ�Ӧ���ྺ�������м�������A�Ļ�ܽϵͣ�����ͬ�������ɻ����м���C���ɲ���A�����ʸ�����ʵ��1�ⶨ�������ʱ�����ж���ϵ����ƽ��״̬����ͼ���֪����C����A��B�ķ�Ӧ��Ϊ���ȷ�Ӧ���ɱ������ݿ�֪���ڽϸߵ��¶��£�Cת��ΪB�о������ƣ���ʵ��1��t minʱ���������¶���25�棬���ֲ���A�ᾭ�����м���Cת���ɲ���B��
��⣺A. ����A��B��Ϊͬ���칹�壬���м�������A��B�ķ�Ӧ���ྺ����A��ȷ��
B. ���м�������A�Ļ�ܽϵͣ�����ͬ�������ɻ����м���C���ɲ���A�����ʸ�����B��ȷ��
C. ʵ��1�ⶨ�������ʱ�����ж���ϵ����ƽ��״̬��C��������
D. ��ͼ���֪����C����A��B�ķ�Ӧ��Ϊ���ȷ�Ӧ���ɱ������ݿ�֪���ڽϸߵ��¶��£�Cת��ΪB�о������ƣ���ʵ��1��t minʱ���������¶���25�棬���ֲ���A�ᾭ�����м���Cת���ɲ���B��D��ȷ��
������������������������C������ѡC��

 ����˼ά�żӿ���ϵ�д�
����˼ά�żӿ���ϵ�д� �����Ծ�ϵ�д�
�����Ծ�ϵ�д� �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д�����Ŀ����ϩ�Ǻϳ�ʳƷ���װ���Ͼ���ϩ�ĵ��壬�����ɶ����ѽ��Ʊ���
����Ӧ��C4H10(g,������)![]() C2H4(g)+C2H6(g) ��H1
C2H4(g)+C2H6(g) ��H1
����Ӧ��C4H10 (g,������)![]() CH4(g)+C3H6(g) ��H2
CH4(g)+C3H6(g) ��H2
�ش��������⣺
��1����ѧ�ϣ����ȶ����ʵ�������Ϊ0�������ȶ�������ʱ�ͷŻ����յ��������������ȣ������ȿɱ�ʾ����������������±�Ϊ25�桢101kPa�¼����л���������ȣ�
���� | ���� | ���� | ��ϩ | ��ϩ | ������ | �춡�� |
������/kJ��mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
����д�Ȼ�ѧ����ʽʱ��Ҫ������ͬ���칹�����ơ�����������_______________________��
��������Ӧ�У���H1=______kJ/mol��
��2��һ���¶��£��ں����ܱ�������Ͷ��һ���������鷢����Ӧ������ϩ��
��������������÷�Ӧ�ﵽƽ��״̬����_______������ţ���
A�������ܶȱ��ֲ��� B��[c(C2H4)��c(C2H6)]/ c(C4H10)���ֲ���
C����Ӧ�Ȳ��� D��������ֽ����ʺ����������������
��Ϊ��ͬʱ��߷�Ӧ���ʺ�ת���ʣ��ɲ��õĴ�ʩ��________________��
��3�����ܱ������г��붡�飬��һ��������Ũ�ȡ�������ѹǿ��)�·�����Ӧ�������ϩ�������¶ȹ�ϵ��ͼ��ʾ���¶ȸ���600��ʱ�������¶����ߣ���ϩ���ʽ��ͣ����ܵ�ԭ����__________�������)��
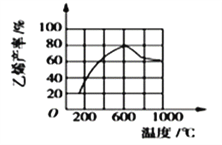
A��ƽ�ⳣ������ B����ܽ���
C���������Խ��� D������������
��4����һ���¶�����1L�����ܱ������г���2mol�����飬��Ӧ������ϩ�����飬����10min�ﵽƽ��״̬�����ƽ��ʱ����ѹǿ��ԭ����1.75����
��0~10min����ϩ����������v(C2H4)Ϊ________mol��L-1��min-1��
�����������£��÷�Ӧ��ƽ�ⳣ��KΪ____________��
��5������-����ȼ�ϵ�������ڵ�K2CO3Ϊ����ʣ��Ծ��д����ú͵������ܵ�ϡ����������Ϊ�缫����ȼ�ϵ�صĸ�����ӦʽΪ______________________________��
��6��K2CO3���ɶ�����̼������������Һ��Ӧ�Ƶá�������,��1 L pH=10��KOH��Һ�г���ͨ��CO2,ͨ��CO2�����(V)����Һ��ˮ�������OH-Ũ�ȵĹ�ϵ��ͼ��ʾ��C����Һ�и�����Ũ�ȴ�С��ϵΪ_________________________________________��