题目内容
【题目】下列反应的离子方程式正确的是( )
A. 氨水中通入少量的SO2气体: SO2+ OH- == HSO3-
B. 氯气与水的反应: Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C. 氯化钙溶液中通入CO2气体: Ca2++H2O+CO2== CaCO3↓+2H+
D. 二氧化锰跟浓盐酸共热制Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
【答案】D
【解析】
A.氨水中通入少量SO2气体,生成SO32-:SO2+2NH3H2O=2NH4++SO32-+H2O;通入过量SO2生成HSO3-:SO2+NH3H2O=NH4++HSO3-,题给离子方程式有2处错误,一是氨水拆写了,一是所给产物与SO2的通入量没有对应,A项错误;
B.生成的次氯酸作为弱酸不拆写,正确的离子方程式为:Cl2+H2O![]() H++Cl-+HClO,B项错误;
H++Cl-+HClO,B项错误;
C.该离子方程式违背了客观事实,氯化钙溶液与CO2不反应,C项错误;
D.二氧化锰作为氧化物、难溶物不拆写,盐酸和氯化锰均拆写成离子形式,D项正确;
答案选D项。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某同学进行下列实验
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 |
放置一段时间后,生铁片上出现如右图所示“斑痕”。其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈 |
下列说法不合理的是
A. 生铁片发生吸氧腐蚀
B. 交界处:4Fe2++O2+10H2O=4Fe(OH)3+8H+
C. 边缘处:O2+2H2O+4e-=4OH-
D. 生铁片发生吸氧腐蚀
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用下图所示的实验装置进行实验。
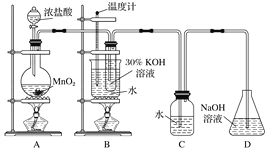
(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的主要玻璃仪器有烧杯、玻璃棒、________________________。
(2)若对调B和C装置的位置,________(填“能”或 “不能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20 mol·L-1 KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0 mol·L-1 H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是__________________________________________。
②若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案:使用下图装置,加热15.0 mL 饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是______________________________________。
(不考虑实验装置及操作失误导致不可行的原因)
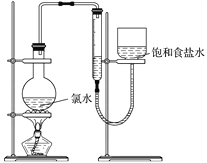
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节): ______________。
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被SO2、H2O2、FeCl2等物质还原成Cl-。


