题目内容
13.(1)把AlCl3溶液蒸干后再灼烧,最后得到的主要固体产物是Al2O3.(2)向纯碱溶液中滴入酚酞溶液,观察到的现象是溶液显红色,原因是(用离子方程式解释)CO32-+H2O?HCO3-+OH-;若再向该溶液中滴入过量氯化钙溶液,观察到的现象产生白色沉淀,且溶液的红色褪去.
分析 (1)AlCl3为强酸弱碱盐,加热促进水解生成氢氧化铝和盐酸,盐酸易挥发,氢氧化铝可分解;
(2)纯碱是强碱弱酸盐碳酸钠,碳酸钠水解而使溶液呈碱性,滴入酚酞,溶液变红;再滴入过量的BaCl2溶液,碳酸根离子和钡离子反应生成碳酸钡沉淀,由于CO32-浓度减小,水解平衡左移,OH-浓度减小,溶液褪色;据此即可解答.
解答 解:(1)AlCl3为强酸弱碱盐,加热促进水解生成氢氧化铝和盐酸,盐酸易挥发,氢氧化铝可分解位氧化铝,所以最后得到的主要固体产物是Al2O3;故答案为:Al2O3;
(2)纯碱是强碱弱酸盐碳酸钠,在纯碱溶液中CO32-易水解生成氢氧根离子:CO32-+H2O?HCO3-+OH-,导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,滴入酚酞,溶液变红;向溶液中加入氯化钡后,钡离子和碳酸根离子反应生成碳酸钡沉淀,Ba2++CO32-═BaCO3↓(白色),由于CO32-浓度减小,水解平衡左移,OH-浓度减小,溶液中只有NaCl和BaCl2,呈中性,所以溶液褪色;
故答案为:溶液显红色;CO32-+H2O?HCO3-+OH-;产生白色沉淀,且溶液的红色褪去.
点评 该题是基础性试题的考查,试题难易适中,基础性强.该题的关键是明确盐类水解的原理,然后结合提高信息灵活运用即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列叙述不正确的是( )
| A. | 裂解和裂化均为化学变化 | |
| B. | 乙烯、苯分子中的所有原子都在同一平面上 | |
| C. | 裂化和裂解均是将相对分子质量大的烃断裂成相对分子质量小的烃的过程 | |
| D. | 实验室蒸馏石油的实验中,冷凝管的水流方向是上方进水下方出水 |
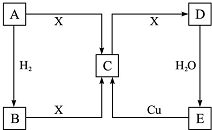 已知A是单质,A、B、C、D、E 5种物质均含同一种元素,X是地壳中含量最多的元素形成的单质,它们的相互转化关系如图所示.试回答下列问题.
已知A是单质,A、B、C、D、E 5种物质均含同一种元素,X是地壳中含量最多的元素形成的单质,它们的相互转化关系如图所示.试回答下列问题.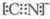 .
.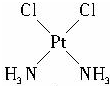 .
.

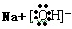 ,含有化学键的类型离子键、极性键;
,含有化学键的类型离子键、极性键;